
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基础医学院向烨团队合作发现甲病毒的新型受体识别机制
【字体: 大 中 小 】 时间:2024年10月13日 来源:清华大学医学院
编辑推荐:
基础医学院向烨团队合作发现甲病毒的新型受体识别机制基础医学 清华大学基础医学院甲病毒(alphavirus)是一类具有囊膜的单链正义RNA病毒。它...
基础医学 清华大学基础医学院

甲病毒(alphavirus)是一类具有囊膜的单链正义RNA病毒。它通过蚊子等节肢动物在人类、鼠、马及鸟等多个物种中广泛传播并引起相关疾病。甲病毒感染人类后可引起发热、肌肉疼痛等症状,严重时可产生中枢神经系统感染,引发重症脑炎,甚至导致死亡。其中一些甲病毒,如东部马脑炎病毒(Eastern Equine Encephalitis virus, EEEV)等,致死率可高达30%以上。迄今为止,仍然没有任何药物或者疫苗被批准用于治疗或预防甲病毒感染。极低密度脂蛋白受体(very low-density lipoprotein receptor,VLDLR)是一种新型的甲病毒受体。VLDLR广泛存在于无脊椎动物和脊椎动物中,能够介导甲病毒EEEV、塞姆利基森林病毒(Semliki Forest Virus, SFV)以及辛德比斯病毒(Sindbis virus,SINV)在多个物种细胞的入侵,可能介导甲病毒的跨物种传播。研究VLDLR介导的甲病毒入侵机制将帮助相关抗病毒防治手段的研发。VLDLR通过其胞外多个富含半胱氨酸重复序列结构域(LDLR class A repeats,LAs)与甲病毒表面的糖蛋白结合,然而具体的结合方式和工作机制尚不清楚。
清华大学基础医学院向烨课题组与中国科学院生物物理研究所章新政课题组合作在前期工作中解析了SFV完整病毒样颗粒与人源受体VLDLR复合物的高分辨率冷冻电镜结构,发现VLDLR结合在SFV贴近囊膜表面的一个全新受体结合位点,并揭示了VLDLR能够通过多个相似串联LA结构域协同作用与SFV病毒表面聚集性受体结合位点结合,从而导致SFV能够耐受不同LAs之间氨基酸序列的局部变化,实现在跨度很大的物种之间广泛传播。这项工作于2023年4月发表于Cell杂志上。然而这项研究鉴定的VLDLR与SFV病毒相互作用的关键性氨基酸残基在另外两种甲病毒EEEV及SINV中并不保守,因此预示着在EEEV及SINV病毒中可能存在不同的受体识别模式。
2024年8月10日,向烨/章新政团队进一步在Nature Communications杂志上发表了题为“The receptor VLDLR binds Eastern Equine Encephalitis virus through multiple distinct modes”的最新研究成果。在这项研究中,团队解析了EEEV完整病毒样颗粒与人源受体VLDLR胞外区的LAs重复序列全长及截短体的多种高分辨率复合物结构,发现在甲病毒EEEV表面存在三个不同的受体结合位点,并且与SFV相比,VLDLR在EEEV病毒表面的结合模式更为复杂,结合生化实验及细胞实验数据,作者最终成功鉴定了LA1-2及LA3-5两种主要的受体串联结合模式。这项研究发现的受体与病毒作用机制不仅与传统甲病毒受体的单一、固定受体结合模式不同,而且与其在SFV病毒表面的聚集性单一位点间形成的串联受体识别模式也完全不同。这种同一受体在不同甲病毒表面的受体识别方式存在巨大差异的现象是非常少见的,进一步刷新了甲病毒与受体相互作用的认知。
与在SFV病毒中贴近囊膜表面的E1-DIII受体结合位点不同的是,在EEEV病毒中VLDLR的三个结合位点均位于远离囊膜表面的E1/E2糖蛋白三聚体的凸起处(图1. A, B)。其中A位点位于相邻E1/E2异源二聚体形成的狭缝处,该位置与传统甲病毒受体的结合位置类似;B位点位于邻近A位点的E2糖蛋白表面;C位点位于E2糖蛋白远端的B结构域(E2 domain B,E2-B)上。除此之外,VLDLR在这三个受体结合位点处结合的LA结构域并不完全固定。在VLDLR胞外区的8个LAs重复序列中,LA1和LA5仅与位点A特异性结合,而LA2、LA3和LA6既能结合位点A又能结合位点C。作者进一步鉴定了LA1-2和LA3-5两种主要的受体串联结合模式:在LA1-2串联结合模式中LA1和LA2分别结合在糖蛋白三聚体中同一组E1/E2异源二聚体的位点A和位点B上(图1. C);在LA3-5串联结合模式中LA3结合在位点C上,而LA5则结合在相邻糖蛋白三聚体的位点A上(图1. D)。这两种受体结合模式均能够介导病毒与细胞表面受体之间的结合以及后续的病毒内吞。有意思的是,位点C上的关键氨基酸残基K206在EEEV病毒中并不保守,在部分EEEV病毒中该位点产生了K206E突变,这将导致在这些病毒中位点C不再介导受体结合,因而带有K206E突变的EEEV毒株与细胞表面受体的结合能力显著减弱。然而疫苗株EEEV-PE6的位点C处仍为K206,因此这项研究提示了应用EEEV PE6毒株作为疫苗株存在的潜在风险。
作者进一步发现将LA1中的关键结合位点突变掉(W50A),从而破坏LA1-2介导的结合模式,会使病毒在细胞表面吸附的能力大大减弱。然而将LA3中的关键结合位点突变掉(W132A),从而破坏LA3-5介导的结合模式,反而会导致病毒在细胞表面的吸附能力明显增强。作者通过结构及功能分析,发现LA3与LA1在位点A处可能存在竞争性结合,当LA3失活以后,受体与病毒的结合模式在较大程度上转变为了以位点A-B介导的LA1-2串联结合模式为主,而由于LA1-2位于VLDLR胞外区的远端,其空间位置和结合姿势可能更有利于病毒在细胞表面的结合。值得注意的是,VLDLR-W132G突变存在于人群中,携带有W132G的人群可能对甲病毒EEEV的感染更为敏感。
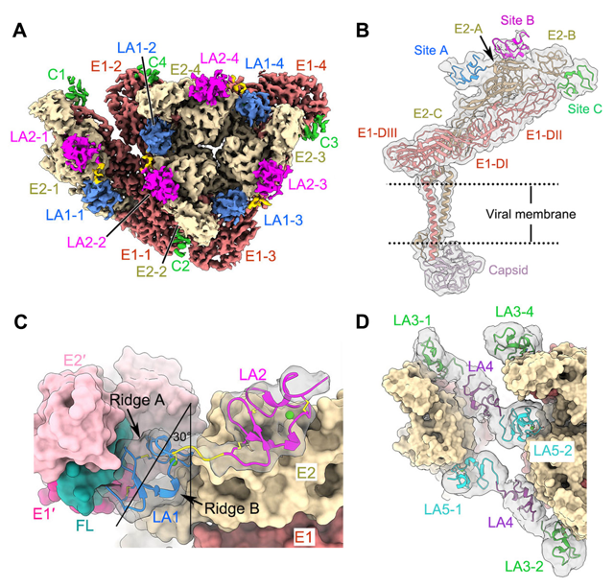
图. VLDLR与甲病毒EEEV的新型受体识别机制
这项研究系统性的展示了新型受体VLDLR在甲病毒EEEV表面复杂多变的受体结合方式,与近期发表在Cell杂志(PMID: 38176410)以及上周在Nature Communications杂志(PMID: 39095394)上发表的两篇文章得出的结论互有补充。连同作者前期对VLDLR与甲病毒SFV识别机制的研究工作(Cell,2023,PMID: 37098345),这些工作通过揭示新型受体在不同甲病毒中不同的受体识别模式,共同帮助理解了甲病毒在多个物种中广泛入侵的传播机制。
清华大学基础医学院、北京生物结构前沿研究中心、清华北大生命联合中心、山西医科大学-清华大学医学院前沿医学协同创新中心向烨研究员和中国科学院生物物理研究所章新政研究员为该论文的共同通讯作者,章新政课题组研究员曹端方、向烨课题组博士后马丙婷和章新政课题组博士研究生曹紫怡为该论文的共同第一作者,向烨实验室2022级博士研究生徐潇雨同学参与了部分研究工作。这项工作得到了中国科技部重点研发项目、清华大学万科公共卫生与健康学科发展专项基金、国家自然科学基金、清华大学春风基金、中国博士后科学基金会、北京生物结构前沿研究中心、清华北大生命联合中心、山西医科大学-清华大学医学院前沿医学协同创新中心、中国科学院战略重点研究计划、中国科学院前沿科学重点研发计划和北京市科技新星计划的资金支持。
论文链接:
https://www.nature.com/articles/s41467-024-51293-x