
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Molecular Cell | 张在荣课题组揭示了一种多次跨膜蛋白的拓扑生成...
【字体: 大 中 小 】 时间:2024年10月13日 来源:中国科学院生物与化学交叉研究中心
编辑推荐:
近期,中国科学院上海有机化学研究所生物与化学交叉研究中心张在荣团队在 Molecular Cell期刊在线发表了题为“ An ATP13A1-assisted topogenesis pathway for folding multi-spanning membrane proteins”的研究论文,揭示了一种由 pTMH指导的多次跨膜蛋白拓扑结构生成途径:新生 pTMH不能立即掺入内质网膜,而是穿越移位子中央孔进入水溶性内质网腔内,由此导致下游 TMHs以与最终结构相反的错误朝向掺入内质网膜
在人类细胞内质网膜上合成的约5000种膜蛋白中,超过半数是多次跨膜蛋白。多次跨膜蛋白在细胞中作为离子通道、转运蛋白、受体蛋白、酶等,发挥着至关重要的作用。这些功能多依赖于跨膜结构域的极性和带电氨基酸,而这些极性和带电氨基酸侧链通常具有排斥脂质的特性,导致其所在跨膜螺旋(TMH)具有较低的疏水性。统计表明,人类蛋白质组中约有30%的膜蛋白和超过50%的多次跨膜蛋白含有至少一个低疏水性的TMH(poorly hydrophobic TMH, pTMH)。在多次跨膜蛋白的成熟结构中,pTMH通常被周围的TMHs保护,从而避免与磷脂双分子层的膜结构直接接触。然而,pTMH常常难以被转位子(translocon)直接识别和插入。这些pTMHs如何被识别并克服磷脂环境的疏水性、如何被包装进入成熟的多次跨膜结构,是领域内尚未完全理解的重要科学问题。
近期,中国科学院上海有机化学研究所生物与化学交叉研究中心张在荣团队在Molecular Cell期刊在线发表了题为“An ATP13A1-assisted topogenesis pathway for folding multi-spanning membrane proteins”的研究论文,揭示了一种由pTMH指导的多次跨膜蛋白拓扑结构生成途径:新生pTMH不能立即掺入内质网膜,而是穿越移位子中央孔进入水溶性内质网腔内,由此导致下游TMHs以与最终结构相反的错误朝向掺入内质网膜。合成结束后,P5-ATPase ATP13A1能识别并纠正“错误”的中间体构型,使得滞留于内质网腔的pTMH变得可识别、并整合、折叠进近成熟的结构,最终获得成熟构象(图1)。
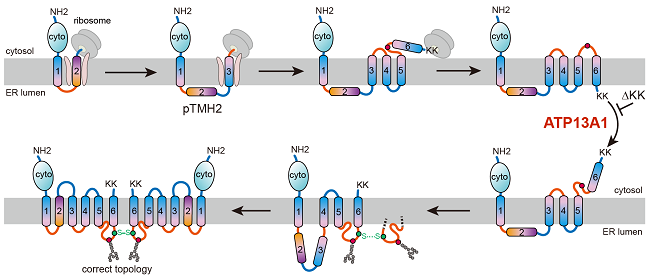
图1. ATP13A1辅助ABCG2拓扑结构生成的途径示意图
以六次跨膜转运蛋白ABCG2和人类细胞作为实验模型,研究人员发现,ABCG2的新生pTMH2可以穿过转位子直接进入内质网腔,从而产生了一个下游TMHs以错误朝向整合入膜的中间体构型状态。当位于羧基端的双赖氨酸翻译结束后,ABCG2的构型出现了几乎全局的拓扑重排过程。进一步研究发现,ATP13A1能感知这一双赖氨酸正电信号,当双赖氨酸被突变为负电或电中性氨基酸后,ATP13A1与ABCG2突变体的相互作用相较野生型大为减弱。敲除ATP13A1导致细胞内大量累积处于折叠中间体状态的ABCG2。ATP13A1能够在多次跨膜蛋白的拓扑结构成熟中发挥作用,其促进了ABCG2中反向插入的TMH6从磷脂双分子层中解离,随后,暴露在细胞质中的TMH6以正确的朝向重新插入内质网摸中,从而驱动上游TMHs的翻译后拓扑重排。
错误朝向的TMHs重排后,这种未成熟中间体能二聚化形成四级结构,可能促进了后续pTMH2与其它跨膜螺旋束的组装,使pTMH2得以整合到膜中,形成pTMH2被其它TMHs所包围的最终结构。这项研究揭示了功能关键但与脂质相斥的pTMH拓扑生成途径,解释了在其通过指导拓扑重排、从而避免在折叠时被过度暴露于脂质环境中。
中国科学院上海有机化学研究所生物与化学交叉研究中心张在荣研究员为本文通讯作者,博士生吉嘉、崔梦珂为共同第一作者。研究工作得到国家自然科学基金委员会、中国科学院和上海市科委的支持。
链接:https://authors.elsevier.com/a/1j3583vVUPRl%7Er