
-

生物通官微
陪你抓住生命科技
跳动的脉搏
陈宇航研究组在气孔运动调控机理研究中取得新进展
【字体: 大 中 小 】 时间:2024年10月13日 来源:中国科学院遗传与发育生物学研究所
编辑推荐:
????2024年7月8日,该研究成果以题为“Mechanistic insights into phosphoactivation of SLAC1 in guard cell signaling”的研究论文在线发表于PNAS (DOI:10.1073/pnas.2323040121)
????作为固着生物,植物不能像动物一样可以通过整体移动来躲避不利的环境因素。面对自然界多种多样的生物和非生物胁迫,植物进化出了独有的适应机制,比如通过气孔介导植物体与外界环境的气体交换来调控自身对环境变化的适应。气孔由成对的肾形保卫细胞构成,它们就像叶子表面上一张张小小的嘴巴,通过开闭运动控制着水分散失和二氧化碳吸收,进而调节植物的蒸腾作用和光合作用。
????在分子水平上,气孔运动由保卫细胞的离子通道所调控。它们通过介导离子跨膜流动来控制保卫细胞膨压变化,进而驱动气孔的运动。在遭遇高浓度二氧化碳、臭氧、干旱和微生物侵袭等环境胁迫时,气孔会关闭以保护植物。在此过程中,慢型阴离子通道SLAC1起到关键作用,其通过感知外界信号并改变自身分子构象来关闭气孔。
????此前,中国科学院遗传与发育生物学研究所陈宇航研究组报道了植物SLAC1第一个冷冻电镜结构(PNAS, 2021)。该结构主要包含主体的跨膜结构域(TMD),而位于膜外的“左膀右臂”(N端~180aa和C端~60aa)由于柔性过大而无法在结构中看见。这些柔性区域携带磷酸化位点,是SLAC1离子通道激活所必需的。前期通过蛋白质质谱和电生理学研究鉴定了6个位于N端的关键磷酸化位点,然而,磷酸化修饰是如何对SLAC1通道“牵一发而动全身”的尚不清楚。
????近期,陈宇航研究组通过生物信息学、电生理学和AlphaFold建模等多种手段进一步揭示了SLAC1的磷酸化激活机制。研究发现,SLAC1柔性的N端和C端部分在胞质内形成调控结构域(CRD),其与TMD互作以维持SLAC1在静息时的自抑制状态。在SLAC1激活过程中,磷酸化修饰引起CRD的构象变化和自抑制的解除。进一步的研究不仅证实了CRD在静息状态下的自抑制功能,而且揭示了其在磷酸化后对维持离子通道开放的必要性。该研究从分子构象、通道活性和生理功能等层面揭示了磷酸化修饰驱动SLAC1通道激活的分子机制,促进了人们从分子层面理解气孔对外界环境变化的感知和响应,研究成果有望为耐旱作物的精准设计和种质创新提供新思路。
????2024年7月8日,该研究成果以题为“Mechanistic insights into phosphoactivation of SLAC1 in guard cell signaling”的研究论文在线发表于PNAS (DOI:10.1073/pnas.2323040121)。陈宇航研究组副研究员秦力和已毕业的博士生邓亚楠、张祥云及唐凌汇为该论文的共同第一作者,陈宇航研究员和哥伦比亚大学Wayne Hendrickson教授为该论文的共同通讯作者。遗传发育所谢旗研究员参与了相关研究工作,实验动物中心的非洲爪蟾设施为电生理学研究提供了重要支撑。该研究得到了科技部重点研发计划、中国科学院战略先导专项、国家自然科学基金和中国博士后科学基金等项目的资助。
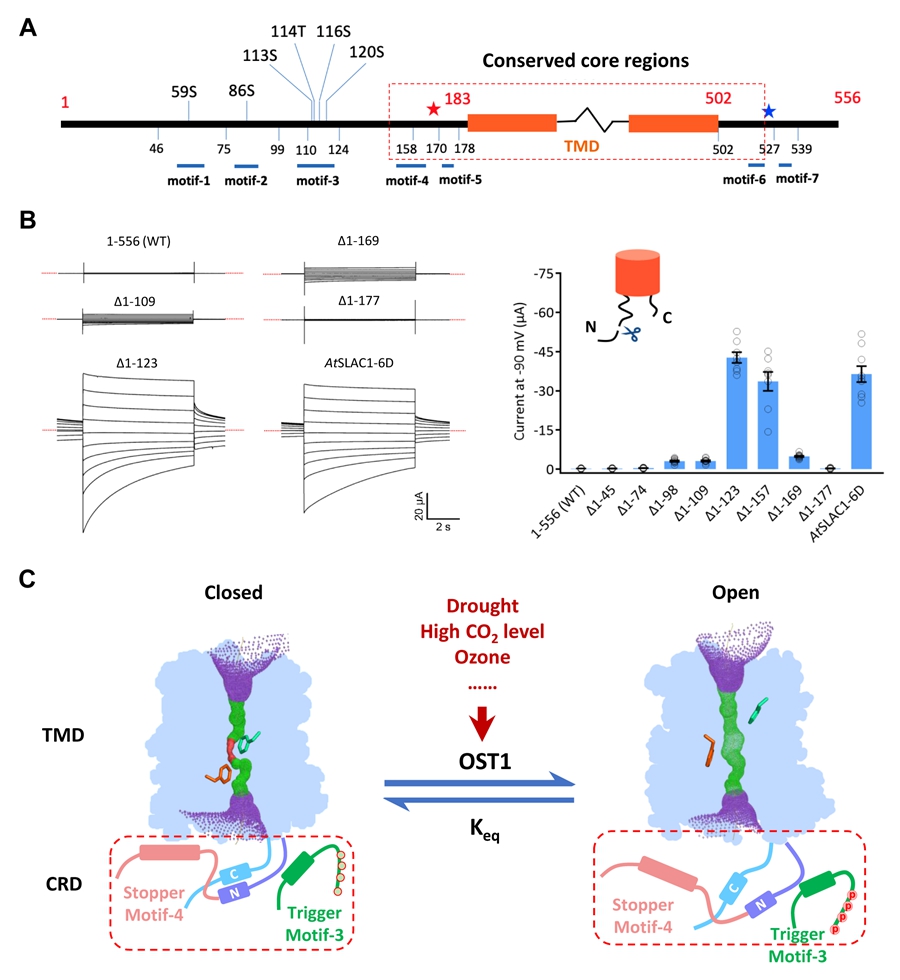
图:SLAC1通道的磷酸化激活机制