
-

生物通官微
陪你抓住生命科技
跳动的脉搏
动物生态与资源保护研究团队发现母体低氧暴露导致子代卵巢功能损伤和繁殖障碍的分子机制
【字体: 大 中 小 】 时间:2024年10月10日 来源:中科院高原生物所
编辑推荐:
相关研究结果以 Fetal hypoxia exposure induced Hif1a activation and autophagy in adult ovary granulosa cells为题,于10月1日在生殖生物学国际期刊?Biology of Reproduction?以Article的形式在线发表
胚胎和胎儿期的发育对于生命的生长轨迹至关重要,在此发育阶段,微小的扰动也会对成年后的健康产生深远影响。孕期暴露于某些不利环境会导致后代出现子宫内膜异位症等多种生殖疾病。此外,孕期母体饥饿或受环境内分泌干扰物影响会降低雌性胚胎原始卵泡池数量,最终影响其成年后的生育能力。胚胎期低氧暴露对成年性腺功能和繁殖能力的影响极为显著。比如,胚胎期低氧会导致颗粒细胞通过Foxo1/PI3K/Akt途径发生自噬性细胞死亡,然而,低氧暴露导致颗粒细胞功能障碍的上游调节机制尚未得到充分解析。
中国科学院西北高原生物研究所和中国农业大学团队利用前期建立的小鼠胚胎期低氧暴露模型,系统研究了母体低氧暴露对子代卵巢颗粒细胞的影响。结果发现,胚胎期低氧会造成雌性小鼠的卵巢卵泡发育异常从而导致生育力下降。通过对其异常发育机制的探究,研究团队发现雌性小鼠胚胎期低氧导致其成年后卵巢颗粒细胞 (Granulosa cells, GCs) 线粒体功能障碍,并且导致GCs自噬性死亡。RNA-seq分析揭示,胚胎期低氧小鼠的成年GCs中存在437个异常表达基因。Western blotting结果显示,胚胎期低氧导致成年GC中低氧诱导因子Hif1a表达水平持续升高。使用Hif-1a抑制剂PX-478处理暴露于低氧环境中的小鼠GCs后,发现自噬和细胞凋亡得到了有效缓解。利用人类卵泡颗粒样肿瘤细胞系(KGN细胞)在体外模拟低氧环境,证明Hif1a通过PI3K/Akt途径调节GCs的自噬性细胞死亡。这些发现表明,胚胎期低氧暴露造成持续的Hif1a表达,损害了GCs的线粒体功能,并导致其发生自噬性细胞死亡进而对雌性成年后生殖功能产生不利影响,而通过抑制Hif1a信号通路可以减轻低氧诱导的GC自噬和细胞死亡。以上研究结果为从胚胎期到成年期的“低氧记忆”形成提供了新的视角,并为改善经历低氧应激女性的生育能力提供了可能的解决方案。
相关研究结果以 Fetal hypoxia exposure induced Hif1a activation and autophagy in adult ovary granulosa cells为题,于10月1日在生殖生物学国际期刊?Biology of Reproduction?以Article的形式在线发表。西北高原所特别研究助理张璐瑶为论文第一作者,西北高原所杨其恩研究员和中国农业大学侯云鹏副教授为共同通讯作者。本研究得到了国家自然科学基金(U22A20447)和青海省自然科学基金(2020-ZJ-902),青海省“昆仑英才”等项目的资助与支持。
论文链接:?https://doi.org/10.1093/biolre/ioae141
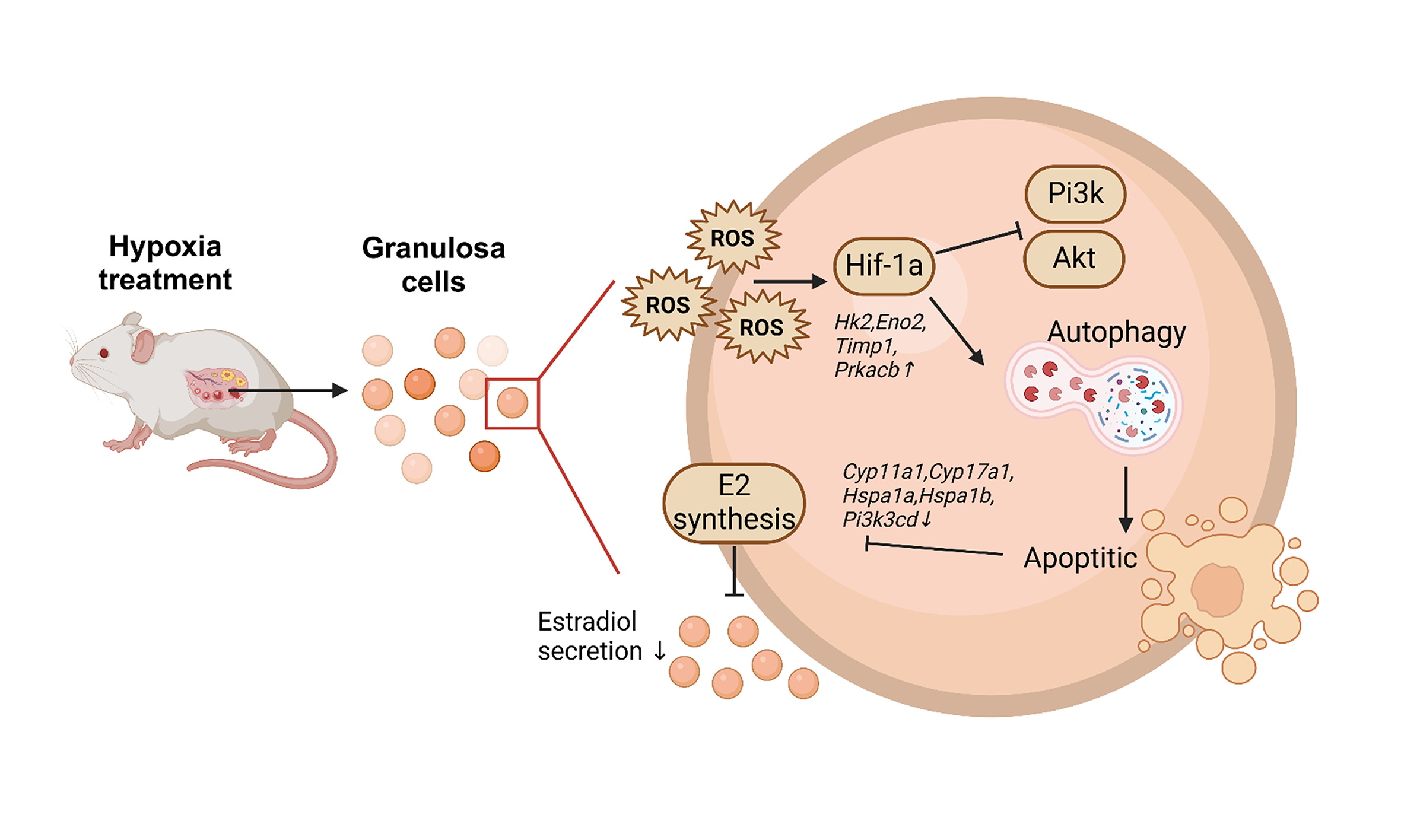
文章模式图:胚胎期低氧诱导成年卵巢颗粒细胞的Hif1a激活和自噬
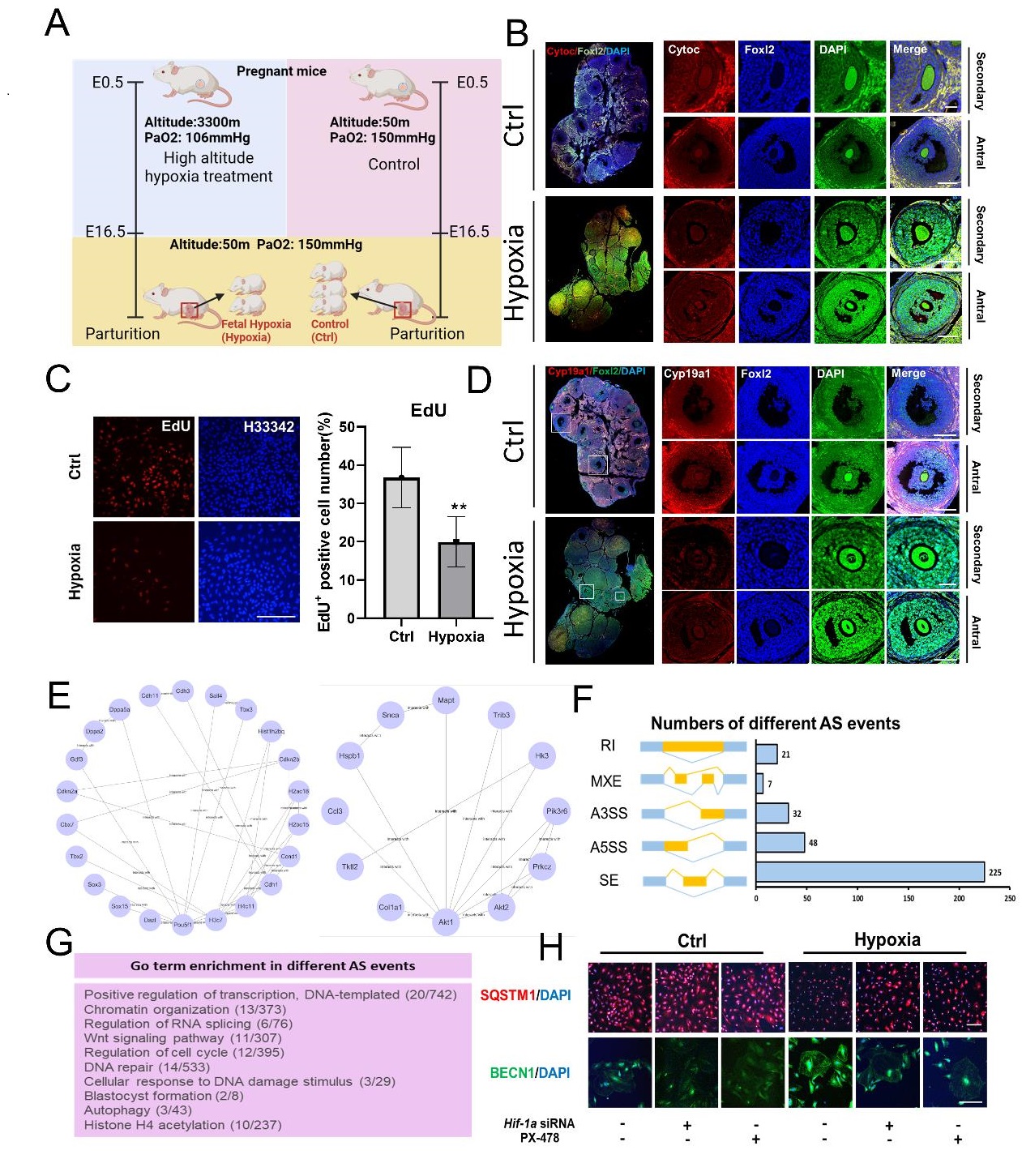
文章代表图:A:胚胎期低氧模型建立示意图;B:细胞色素C免疫荧光染色;C:体外细胞培养EdU细胞增殖活性检测;D:雌激素合成转化关键酶Cyp19a1免疫荧光染色;E:转录因子PPI富集分析图;F:不同类型可变剪切差异统计;G:不同可变剪切事件发生基因的Go富集分析;H:体外实验通过转染Hif-1a SiRNA 和抑制剂添加检测自噬相关蛋白表达水平