
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院肖俊宇课题组揭示IgM–CD5L复合物的分子机制
【字体: 大 中 小 】 时间:2024年10月02日 来源:北京大学新闻网
编辑推荐:
为了进一步探究CD5L作为IgM的结合蛋白是否影响IgM的功能,本研究通过结构生物学、生物化学和细胞生物学手段阐明了CD5L结合IgM的分子机制,为更全面地了解IgM与CD5L的生物学功能奠定了基础。
IgM是人体五种免疫球蛋白之一,在体液免疫和黏膜免疫中发挥重要作用。IgM主要以五聚体形式存在。J链调控IgM五聚体的组装,还能通过与黏膜转运受体pIgR的相互作用,介导IgM的黏膜转运1。蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大-清华生命科学联合中心、昌平实验室肖俊宇教授课题组一直聚焦IgM分子机制的相关研究,在先前的工作中阐明了IgM五聚体组装和黏膜转运的机制2,特异性受体FcμR识别IgM的机制3,以及恶性疟原虫蛋白结合IgM的机制4。
血清IgM中除J链外还存在另一种称为CD5L(CD5 antigen-like)的蛋白,也被称为Spα或AIM。它是一种由巨噬细胞表达和分泌的蛋白,属于清道夫受体半胱氨酸富集超家族(Scavenger Receptor Cysteine-Rich superfamily, SRCR)。CD5L/Spα/AIM被报道有多种功能,可作为模式识别受体识别病原体和内源性有害物质,能抑制胸腺细胞、T细胞等的细胞凋亡,还参与肥胖、动脉粥样硬化等疾病的病理进程。因此,CD5L在维持免疫稳态和疾病发展中具有重要作用5。IgM五聚体被认为是CD5L的载体,保护其免于肾脏清除。然而,IgM与CD5L相互作用的分子基础仍不清楚,CD5L对于IgM功能的影响也有待进一步研究。
9月27日,肖俊宇课题组在Nature Communications期刊在线发表了题为“CD5L associates with IgM via the J chain”的研究成果,揭示了CD5L通过J链结合IgM的分子机制,同时探讨了CD5L对IgM功能的影响。
CD5L在哺乳动物中高度保守,包括三个SRCR结构域。SRCR结构域通常具有双阳离子结合位点,在配体结合中具有关键作用。为了探索IgM与CD5L相互作用的具体机制,本研究首先重组表达了IgM五聚体核心区(Fcμ–J)和CD5L蛋白,然后通过表面等离子共振技术研究了二者的相互作用,发现CD5L 确实以Ca2+依赖的方式结合IgM。之前曾有研究显示,猫源CD5L与IgM 之间具有显著更强的亲和力,而这种强结合被认为与猫更易患肾脏疾病相关6。为了探究不同种属IgM与CD5L的亲和力是否有较大差异,本研究也研究了猫源和鼠源IgM与CD5L的相互作用。结果显示,不同种属CD5L均以Ca2+依赖的方式结合IgM,并且各种属间CD5L与IgM的亲和力总体较为相似,说明IgM–CD5L相互作用在哺乳动物中具有保守性。
本研究利用冷冻电镜解析了人源Fcμ–J和CD5L复合物的高分辨率结构。结构显示,五个Fcμ以非对称形式组装成带有一个缺口的五聚体,J链和CD5L填补于缺口处,与先前的研究结果一致7。CD5L的SRCR3结构域与Fcμ–J的中心结合,并与J链的多个区域相互作用。SRCR2结构域向Fcμ5B摆动,并将J链的β5–β6发夹结构压向Fcμ5B。值得注意的是,这段β5–β6发夹结构在以前所有不含CD5L的IgM结构中都处于无序状态。CD5L-SRCR1结构域和Fcμ-Cμ2结构域的密度较弱,因此无法清晰地观察到。SRCR3结构域中含有一个完整的双阳离子结合位点,电镜密度图和结构信息比对支持此处结合了两个Ca2+,有助于稳定附近的负电荷表面区域。此外,CD5L与IgM之间还形成一个二硫键从而进一步稳定二者的相互作用。
为了进一步探究CD5L作为IgM的结合蛋白是否影响IgM的功能,本研究探究了CD5L对IgM受体pIgR和FcμR结合的影响,以及对IgM激活补体能力的影响。结果显示,CD5L能显著降低IgM与pIgR的结合,但不影响FcμR的结合或补体激活。通过影响IgM和pIgR的相互作用,CD5L可能会阻碍IgM 的黏膜转运,从而帮助IgM留在血液中。这些结果与Oskam等人近期的报道8相吻合。
总之,本研究通过结构生物学、生物化学和细胞生物学手段阐明了CD5L结合IgM的分子机制,为更全面地了解IgM与CD5L的生物学功能奠定了基础。
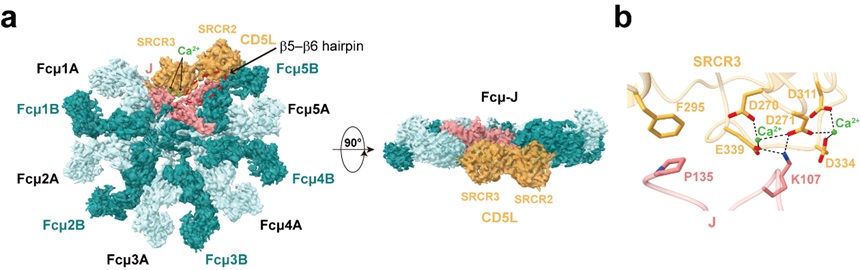
Fcμ–J与CD5L复合物的整体结构和双阳离子结合位点的局部结构
肖俊宇为该论文的通讯作者。北京大学生命科学学院博雅博士后王禹心和2020级博士生苏晨为该论文的共同第一作者。北京大学博雅博士后纪成功为该论文提供了帮助。本研究得到了国家自然科学基金和北京大学生命科学学院启东产业创新基金的支持。北京大学冷冻电镜平台和生命科学学院仪器中心为本项目提供了重要帮助。
参考文献
1. Matsumoto, M.L. Molecular Mechanisms of Multimeric Assembly of IgM and IgA. Annual Review of Immunology 40, 221—247 (2022).
2. Li, Y. et al. Structural insights into immunoglobulin M. Science 367, 1014—1017 (2020).
3. Li, Y. et al. Immunoglobulin M perception by FcmuR. Nature 615, 907-912 (2023).
4. Ji, C. et al. has evolved multiple mechanisms to hijack human immunoglobulin M. Nature Communications 14(2023).
5. Sanjurjo, L. et al. AIM/CD5L: a key protein in the control of immune homeostasis and inflammatory disease. Journal of Leukocyte Biology 98, 173—184 (2015).
6. Miyazaki, T. et al. AIM associated with the IgM pentamer: attackers on stand-by at aircraft carrier. Cellular & molecular immunology 15, 563—574 (2018).
7. Hiramoto, E. et al. The IgM pentamer is an asymmetric pentagon with an open groove that binds the AIM protein. Science Advances 4(2018).
8. Oskam, N. et al. CD5L is a canonical component of circulatory IgM. Proceedings of the National Academy of Sciences 120, e2311265120 (2023).