
-

生物通官微
陪你抓住生命科技
跳动的脉搏
?生命科学学院李根喜团队报道HER2阳性乳腺癌诊断新技术
【字体: 大 中 小 】 时间:2024年01月13日 来源:南京大学生命科学学院
编辑推荐:
上述研究成果以“ DNA framework-controlled Poly(MOFs) as a visual platform for diagnosis of HER2-positive breast cancer ”为题发表在 Nano Today 上( https://doi.org/10.1016/j.nantod.2023.102143 ),李根喜教授、殷咏梅教授以及赵婧教授为文章的共同通讯作者,我校生命科学学院 2020 级博士研究生梁齐志为文章的第一作者
目前对乳腺癌采取的诊断方法主要基于影像学技术、组织活检技术和基因筛查技术,这些技术虽然成熟,但也存在一些缺陷,因而急需发展新的诊断技术。人表皮生长因子受体2(HER2)是一种跨膜蛋白,在约20-25%的乳腺癌中过度表达。目前已有的研究表明,HER2过表达会增强乳腺癌细胞的侵袭性和攻击性,并可能与乳腺癌复发可能性的增加和预后较差有关。大量证据表明,在早期对HER2进行精准的检测对提高乳腺癌患者的生存情况有着显著的影响。近期,我校生命科学学院李根喜教授与上海大学赵婧教授、南京医科大学附属江苏省人民医院殷咏梅教授合作,基于DNA框架控制的Poly(MOFs)构建了一种具有优异分析性能的比色生物传感器,可以在分子水平以及细胞水平实现对HER2的分析,并用于HER2阳性乳腺癌患者的诊断。
金属有机框架(MOFs)由于具有极高的比表面积、超高孔隙率和可调孔隙结构,在设计、合成、改性和功能方面已经取得了许多有价值的进展,因而在生物传感、医学成像、药物输送等生物医学领域受到了广泛关注。MOFs理想的纳米生物界面可以提高其稳定性、靶向性和生物相容性,这也是其生物医学应用的基础。目前,MOFs纳米生物界面的工程化主要包括核酸、多肽、抗体等功能探针的使用,仍然存在许多明显的困难和挑战: (1) MOFs表面有限的活性基团数量; (2) MOFs表面吸附导致的纳米探针识别效率低; (3) MOFs纳米界面的功能化方法较少; (4) MOFs纳米材料的利用效率较低。因此,迫切需要利用纳米生物界面工程技术构建性能更加优越的MOFs,使其可以更加稳定、高效、经济地应用于生物医学领域。近期,我校生命科学学院李根喜教授与合作者发现了一种可以控制MOFs纳米材料发生自组装的新方法。该方法主要通过使用DNA框架材料(四面体DNA)来控制MOFs纳米材料的组装(图1),尤其是可以通过调节与催化Zr-MOFs配位的磷酸基团的数量来定制各种明确的超结构,以创建聚合物MOFs超结构(Poly(MOFs))。研究发现,这种超结构表现出优异的催化活性和分子识别能力,并极大地放大了信号的输出。研究团队进一步基于DNA框架控制的Poly(MOFs)构建了一种具有优异分析性能的比色生物传感器,可以在分子水平以及细胞水平实现对靶标的分析,并用于人类表皮生长因子受体2 (HER2)阳性乳腺癌的诊断。
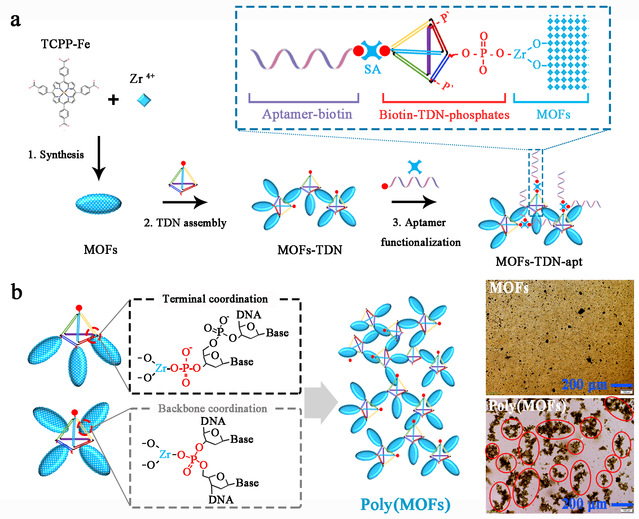
图1:MOFs纳米探针的合成与修饰及组装成Poly(MOFs)的原理图。图片来源:Nano Today
研究团队首先详细地探究了四面体DNA(TDN)诱导MOFs发生自组装的过程以及影响自组装程度的关键因素。TDN修饰到MOFs纳米材料表面的原理主要是通过TDN顶点修饰的磷酸基团与MOFs纳米材料表面的锆离子间的配位相互作用。研究发现,单链DNA修饰的MOFs并不能诱导MOFs发生自组装,而TDN却能剧烈地诱导MOFs发生自组装(图2)。实验结果显示,TDN顶点上含有的游离磷酸基团越多,MOFs自组装的程度则越高,而且,TDN的浓度对MOFs的组装具有关键性作用,过高或者过低浓度的四面体DNA都不利于MOFs的自组装。
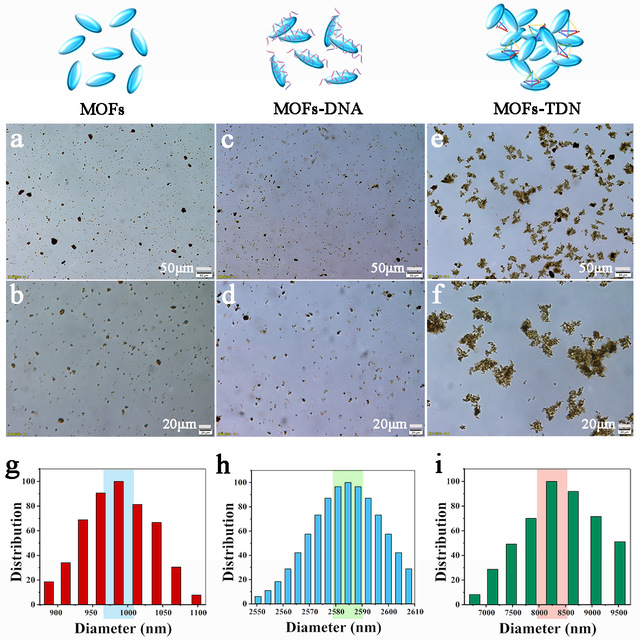
图2:四面体DNA诱导MOFs发生自组装。图片来源:Nano Today
随后,基于TDN控制的MOFs自组装现象,研究团队研制了一个可视化生物传感器用于HER2阳性乳腺癌的诊断(图3)。该生物传感器主要包括两个模块:磁珠捕获模块(MTM)和基于TDN诱导MOFs组装的信号输出模块(SOM)。MTM通过生物素-亲和素作用将生物素修饰的DNA适配体与链霉亲和素修饰的MBs连接而构成。根据设计,靶标(HER2)首先被滚环扩增(RCA)后的多价DNA适配体功能化的MBs (MBs-mApt)捕获和分离。然后MOFs-TDN-apt识别并结合MBs捕获的HER2。最后,利用具有纳米酶活性的MOFs材料PCN - 222 (Fe)催化3,3 ',5,5 ' -四甲基联苯胺(TMB)发生氧化还原反应生成蓝色氧化态,通过MBs表面自组装MOFs与RCA的双重信号放大手段实现对靶标的高灵敏检测。
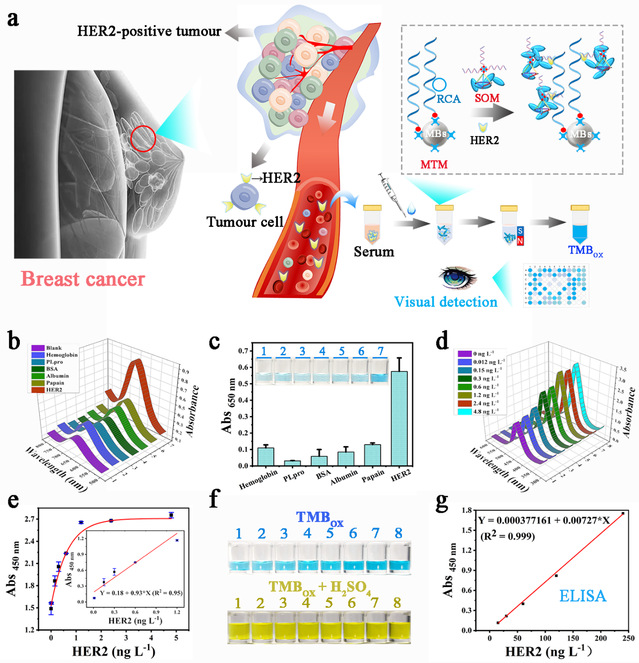
图3:基于MOFs可控组装的生物传感器用于HER2阳性乳腺癌诊断的原理及实验结果。图片来源:Nano Today
研究团队进一步对该生物传感器的可行性进行了验证,并从已知的三种DNA适配体和一种多克隆抗体中筛选出两条可以同时高效识别靶标的探针。经过对可能影响该生物传感器性能的一系列参数进行优化以后,不仅实现了在分子水平上对靶标蛋白的稳定且灵敏的检测,而且在细胞水平上实现了对靶标蛋白表达水平的监测。最后,研究团队使用乳腺癌病人的血清样本对该生物传感器进行了验证,结果发现其可以有效地区分出HER2阳性和阴性的乳腺癌患者,表明出具有巨大的临床应用潜力,有望为HER2阳性乳腺癌的早期诊断和靶向治疗的疗效监测提供新的方法和可选择的辅助手段。由于该工作中使用的适配体可以针对其他靶标进行改变,而DNA框架控制的Poly (MOFs)的组装是相同的,因此该工作也可用于其他类型乳腺癌标志物的分析及诊断应用,也有望用于其他疾病的生物标志物的分析及临床检验。
上述研究成果以“DNA framework-controlled Poly(MOFs) as a visual platform for diagnosis of HER2-positive breast cancer”为题发表在Nano Today上(https://doi.org/10.1016/j.nantod.2023.102143),李根喜教授、殷咏梅教授以及赵婧教授为文章的共同通讯作者,我校生命科学学院2020级博士研究生梁齐志为文章的第一作者。该研究得到了国家自然科学基金、中央高校基本科研业务费专项资金以及江苏省研究生科研创新项目的支持。