
-

生物通官微
陪你抓住生命科技
跳动的脉搏
衰老骨髓造血干细胞劫持调节性T细胞营造促其存活的微环境
【字体: 大 中 小 】 时间:2023年09月19日 来源:国家自然科学基金委员会
编辑推荐:
研究成果以“衰老骨髓造血干细胞劫持调节性T细胞营造促其存活的微环境(Aged hematopoietic stem cells entrap regulatory T cells to create a prosurvival microenvironment)”为题,于2023年8月30日在线发表于《细胞与分子免疫学》(Cellular & Molecular Immunology)
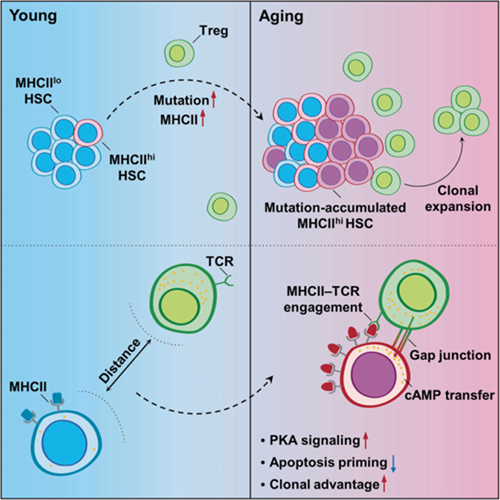 |
图 骨髓Tregs在HSC衰老中的调控作用 在国家自然科学基金项目(批准号:81930090、81725019、82273571)等资助下,陆军军医大学王军平教授、叶丽林教授等团队合作,在骨髓造血辐射远期损害效应发生机制研究方面取得新进展。研究成果以“衰老骨髓造血干细胞劫持调节性T细胞营造促其存活的微环境(Aged hematopoietic stem cells entrap regulatory T cells to create a prosurvival microenvironment)”为题,于2023年8月30日在线发表于《细胞与分子免疫学》(Cellular & Molecular Immunology)。论文链接:https://www.nature.com/articles/s41423-023-01072-3。 骨髓造血组织是电离辐射敏感组织,造血-免疫功能异常是放射损害远期效应的主要表现,但电离辐射致骨髓造血远期损害的机制亟待阐明。该研究团队发现,电离辐射可导致衰老骨髓造血干细胞(HSCs)中的DNA突变持续累积,并诱导其表面主要组织相容性复合体(MHC)II类分子的表达上调。MHCII表达上调增加了衰老HSCs与骨髓调节性T细胞(Tregs)识别的机会,进而导致Tregs克隆扩增并在造血微环境中积累。通过缝隙连接蛋白43(Cx43)建立缝隙连接,Tregs向衰老HSCs传递环磷酸腺苷(cAMP),并激活蛋白激酶A(PKA)信号,从而抑制衰老HSCs的凋亡启动,促进其存活及优势扩增,最终导致髓系偏向分化增强及免疫功能低下等造血远期损害效应(图)。此外,靶向HSC-Treg交叉对话或清除Tregs均可有效减轻电离辐射诱导的骨髓造血远期损害效应。 该研究解析了电离辐射致骨髓造血远期损害的效应与机制,拓展了衰老HSCs存活及优势扩增发生机制的认识,为电离辐射致骨髓造血远期损害的防治提供了新思路。