
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Communications | 朱应、刘实团队揭示天然免疫关键蛋白MAVS在介导天然免疫信号转导和葡萄糖代谢之间相互作用的新机制
【字体: 大 中 小 】 时间:2023年09月07日 来源:武汉大学病毒学国家重点实验室
编辑推荐:
2023 年9 月2 日,国际学术期刊Nature Communications 在线发表了武汉大学病毒学国家重点实验室/ 生命科学学院朱应、刘实团队的最新研究成果,论文题为“MAVS integrates glucose metabolism and RIG-I-like receptor signaling”
2023年9月2日,国际学术期刊Nature Communications在线发表了武汉大学病毒学国家重点实验室/生命科学学院朱应、刘实团队的最新研究成果,论文题为“MAVS integrates glucose metabolism and RIG-I-like receptor signaling”。该研究工作揭示了RIG-I样受体(RLR)信号转导通过接头蛋白MAVS驱动糖代谢从糖酵解到磷酸戊糖途径(PPP)和己糖胺生物合成途径(HBP)转变的新机制,为进一步理解天然免疫过程中的能量代谢转换提供新思路。

MAVS是参与线粒体、过氧化物酶体和线粒体相关内质网膜(MAM)中的RIG-I样受体(RLR)信号转导的接头蛋白。目前,MAVS在葡萄糖代谢和RLR信号转导中的交叉调节作用,以及这些信号通路如何在这些细胞器之间相互协调尚未明确。在这项研究中,通过细胞、动物模型并结合代谢组学分析及同位素标记葡萄糖碳流追踪实验等手段揭示过氧化物酶体MAVS负责将葡萄糖通量转向PPP和III干扰素表达,而位于MAM的MAVS负责将葡萄糖通量转向HBP和I型干扰素表达。进一步的机制研究显示,过氧化物酶体MAVS通过与葡萄糖-6-磷酸脱氢酶(G6PD)相互作用,并通过招募TNF受体相关因子6(TRAF6)和干扰素调节因子1(IRF1)在过氧化物酶体上形成MAVS信号体。而位于MAMs的MAVS与谷氨酰胺-6-磷酸果糖转氨酶2(GFPT2)相互作用,通过招募TRAF6和TRAF2在MAMs形成MAVS信号体。当利用药物抑制PPP途径,G6PD和MAVS之间的相互作用也相应减少,进而降低III型IFN的产生。另一方面,抑制HBP途径会干扰GFPT2和MAVS之间的相互作用,减少I型IFN的产生。总而言之,该研究揭示了RLR信号通过不同细胞器定位的MAVS调节葡萄糖代谢重编程的机制。
武汉大学生命科学学院何巧巧博士、博士研究生黄玙、博士研究生聂龙宇为该论文的共同第一作者,朱应教授和刘实教授为本文共同通讯作者。本工作得到了国家重点研发计划(2021YFC2701800,2021YFC2701804)、国家自然科学基金(U22A20335)、湖北省杰出青年科学基金(2021CFA054)等项目的资助。
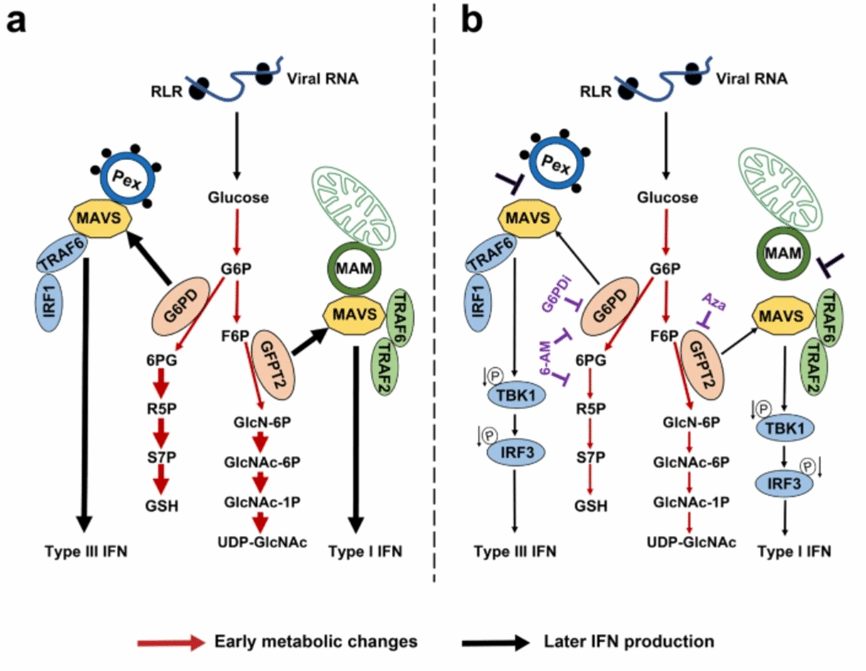
MAVS介导RLR信号转导与葡萄糖代谢之间的相互作用的模式图。图片来源:Nat. Comm.
论文链接:https://www.nature.com/articles/s41467-023-41028-9