
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞空间技术探秘动物世界连载[2]:揭开蛛丝的秘密
【字体: 大 中 小 】 时间:2024年07月10日 来源:10x Genomics
编辑推荐:
中国西南大学的科学家团队近日在《Nature Communications》杂志上发表论文(1),介绍了对金丝圆蛛的大壶状(Ma)腺的多组学研究。
尽管我们不想扫蜘蛛侠所有粉丝的兴,但人类目前还无法编织这些蜘蛛网——无论是用于医疗、商业还是超级英雄电影。大自然在这一点上做得最好。
不过,在单细胞和空间转录组学技术的帮助下,科学家正在确定一个神奇物种产丝的分子机制,这个物种就是产金丝的棒络新妇蜘蛛(Trichonephila clavata),又被贴切地称为金丝圆蛛。
对金丝圆蛛的产丝器官(大壶状腺)的细胞组成和结构排布的详细了解,再加上关于超强蛛丝物理和材料特性的现有知识,有望为人类提供信息,帮助我们根据自身的需求(比如从屋顶上纵身跃下)来生产经过优化的合成丝(1)。
蜘蛛大壶状腺,而不是蜘蛛侠,才是生产蛛丝的超级英雄
中国西南大学的科学家团队近日在《Nature Communications》杂志上发表论文(1),介绍了对金丝圆蛛的大壶状(Ma)腺的多组学研究。这个腺体可帮助蜘蛛生产牵引丝,蜘蛛可利用这种丝来编织令人害怕的圆形蛛网,甚至进行飞航(ballooning),这是他们空中旅行的一种方式(1,2)。

棒络新妇蜘蛛的丝腺形态学。改编自Hu W等人的图1g和图2a (1)。知识共享许可协议4.0。
大壶状腺由三个不同区段组成:尾部、囊腔和导管。利用批量细胞RNA-seq,研究团队表征了每一段的转录特征,希望以此来追踪牵引丝28个蛋白成分的来源,并确定蛛丝生产的分子机制。根据转录组和蛋白质组分析结果,他们发现尾部和囊腔作为泌丝的主要区段有着相似的分子功能。具体来说,尾部富含与有机酸合成相关的基因,而囊腔富含与脂类合成相关的基因。导管中的基因则主要与离子(Ca2+和H+)交换和甲壳素(蜘蛛外骨骼的主要成分)合成有关(1)。
利用细胞和空间见解来探索蛛丝生产的机制
为了建立蛛丝生产的细胞机制,研究团队使用Chromium单细胞基因表达技术来鉴定组成大壶状腺的细胞类型。他们分析了9,349个细胞,并根据基因表达确定了10个分子功能不同的独特细胞群。其中一些细胞群包括大壶状腺起源细胞,以及负责生产蛛丝主要蛋白成分的多个细胞类型,这些细胞来源于尾部和囊腔区段。他们还鉴定出脂类合成细胞、甲壳素合成细胞和pH调节细胞等(1)。
研究团队随后对这些细胞群的发育轨迹进行排序,发现了从大壶状腺起源细胞开始的连续细胞群,这些起源细胞聚集在尾部,并分支形成另外两个主要区段——囊腔和导管。此外,利用Visium空间基因表达分析,他们还绘制了大壶状腺内各个细胞群的空间排布,重点放在分泌蛛丝蛋白的细胞。结果证实了它们定位在尾部和囊腔区段。
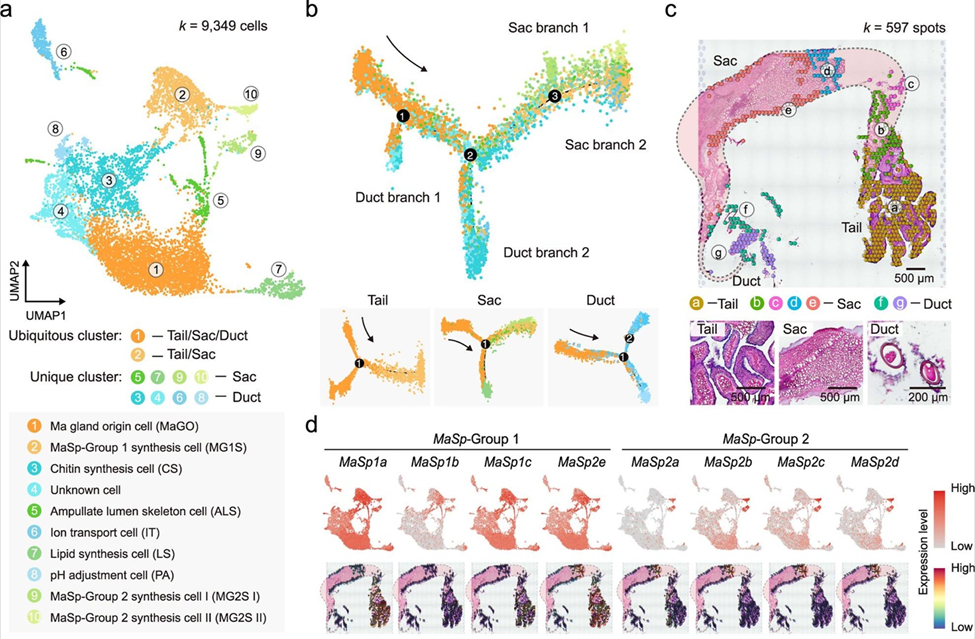
单细胞和空间转录组学(ST)数据的可视化,改编自Hu W等人的图4a-d(1)。a. 大壶状腺的细胞类型分析,具体分为10个细胞簇。白色圆圈中的数字代表细胞簇。b.全部9,349个大壶状腺细胞的拟时序分析。每个点代表一个细胞,细胞簇的颜色编码如(a)所示。黑色圆圈中的数字代表分支位置。c. 大壶状腺切片的苏木精/伊红染色以及空间转录组学(ST)数据点的无偏聚类。d. MaSp(蛛丝蛋白)家族中各个基因表达的UMAP和ST特征图。知识共享许可协议4.0。
将单细胞和空间数据集结合起来,研究团队能够进一步完善独特细胞簇的分子功能,并根据35个区段特异性基因表达特征的比对,将单细胞和空间转录组学细胞簇划分为“集合(set)”。这一功能图谱确定了单个细胞簇的特定功能,如细胞簇2已被证明在有机酸代谢过程和氧化还原酶活性中发挥作用,同时确定了它们在腺体组织的特定区域内的位置(1)。
这些详细的见解不仅从机理上解释了大壶状腺的发育过程,还解决了长期以来关于大壶状腺细胞组成的科学争论,包括独特细胞类型的数量,以及哪些细胞负责产生蛋白质,最终促成牵引丝达到惊人的强度和弹性。
揭开复杂动物和人类的生物学秘密
大自然不断带给我们惊喜和超越。随着科学家开始用高分辨率工具来深入探索复杂的生物学机制,这些机制造就了自然界中令人惊叹的特征(比如圆蛛编织的网),谁知道我们下一步会发现什么。无论是章鱼的照相机式眼睛、墨西哥蝾螈的神经再生,还是作为新兴模式生物的兔子的胚胎发育,这背后的生物学机制都值得我们去探索。
不过,不仅仅是自然界拥有不为人知的秘密。人类生物学以及它在发育和疾病过程中如何出错,也必须得到更多关注。单细胞和空间工具及其综合分析能力有着巨大的潜力,可支持新一轮的发现,并对转化医学和临床改进产生影响。
如果您对我们的产品和技术感兴趣
欢迎扫码留下联系方式

本文基于如下10x博客生成:
https://www.10xgenomics.com/cn/blog/untangling-spider-silk-secrets-with-multidimensional-analysis
参考文献:
1.Hu W, et al. A molecular atlas reveals the tri-sectional spinning mechanism of spider dragline silk. Nat Commun. 14: 837 (2023). doi: 10.1038/s41467-023-36545-6
2.Trichonephila clavata. Updated: March 23, 2023. https://a-z-animals.com/animals/joro-spider/
Social share image credit Micha L. Rieser.
https://commons.wikimedia.org/wiki/File:Nephila-clavata-f-eating-and-2-m.jpg?uselang=en#Licensing