
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院季雄团队揭示亚细胞定位对RNA聚合酶III命运调控的决定性作用
【字体: 大 中 小 】 时间:2023年08月25日 来源:北京大学新闻网
编辑推荐:
该研究利用蛋白快速降解和活细胞实时标记系统发现,RNA聚合酶III在细胞质中通过分子伴侣蛋白的协助进行组装,部分留在细胞质中发挥与天然免疫相关的功能,其余部分进入细胞核内发挥转录功能,并最终在细胞核内经过蛋白酶体系统降解。
哺乳动物细胞核中的基因转录过程由三种RNA聚合酶复合物(Pol I、II、III)相互协同完成。其中,RNA聚合酶III(Pol III)不仅是细胞核内转录tRNA、5S rRNA、SINEs等短基因的核心机器[1],还参与DNA双链断裂的同源重组修复[2],同时在细胞质中通过转录富含A-T的DNA病毒模板来触发天然免疫[3, 4]。与其他两种RNA聚合酶主要定位于细胞核内发挥功能不同,Pol III在细胞质中作为病毒DNA的感知器同样具有转录活性,但细胞质和细胞核内Pol III的组装和分布调控机制尚不清楚。
近日,北京大学生命科学学院、北大-清华生命科学联合中心季雄研究员课题组在Cell Reports杂志上在线发表了题为“Subcellular localization shapes the fate of RNA polymerase III”的研究论文。研究中对Pol III的组装和降解进行了分析,利用蛋白快速降解系统、活细胞邻近标记的蛋白质组和活细胞荧光次序标记的实时成像系统,发现Pol III核心催化亚基RPC1的降解会导致细胞核内Pol III复合物的快速降解,而在细胞质中则会形成去组装的Pol III中间亚复合体,这些中间体不会被降解,并且在RPC1蛋白水平恢复时重新组装成Pol III复合物并进入细胞核。研究还发现,蛋白酶体和分子伴侣HSP90在细胞核中对Pol III的稳态调控起着关键作用,并推测Pol III由细胞质进入细胞核是一个单向过程,即Pol III首先在细胞质中组装为核心复合物,然后在细胞核中成熟为完整的全酶从而执行转录功能。

论文截图
为了研究Pol III的生命周期(life cycle),研究者在小鼠胚胎干细胞(mESC)中对内源亚基进行基因编辑。其中,一个亚基采用蛋白瞬时降解标签(Degron),另一个不同亚基采用HaloTag标签或TurboID标签进行活细胞标记。当诱导Degron标记的亚基发生降解时,通过实时荧光标记成像检测发现Pol III的其他亚基在细胞核内逐渐减少,而在细胞质中除了被诱导降解的亚基外,其他亚基的蛋白水平变化不大。有趣的是,研究发现亚基RPC3主要定位在细胞核,即使细胞核内的Pol III全酶降解后,RPC3仍然滞留在核内,并与RPC6形成稳定的亚复合物。
为了确定细胞核内亚基减少是否是由于Pol III去组装后被运出细胞核,研究者对细胞进行了出核抑制剂处理,并发现这并未影响Pol III在细胞核内的亚基减少。然而,当采用蛋白酶体抑制剂处理细胞时,细胞核内出现了Pol III亚基的积累现象。同时,研究者使用邻近标记(RPC2-TurboID)的方法尝试捕获参与Pol III命运决定的蛋白质,当RPC1被诱导降解时,通过比较降解前后的蛋白质组差异,发现辅助蛋白质去折叠的分子伴侣和参与蛋白质降解的组分在细胞核内富集。这些结果表明,细胞核内的Pol III最终通过细胞核内的蛋白酶体降解而不是被运送到细胞质中进行处理。
随后,研究者利用HaloTag标记RPC2的不同颜色形成时序标记,以区分新旧蛋白质,并根据标记的时间顺序区分它们。通过人为控制RPC1的降解和蛋白表达的恢复,研究者发现,当RPC1表达恢复后,细胞质中的新旧RPC2仍然可以重新组装成功能完整的Pol III复合物,并被运送到细胞核内发挥功能。
综上所述,该研究利用蛋白快速降解和活细胞实时标记系统发现,RNA聚合酶III在细胞质中通过分子伴侣蛋白的协助进行组装,部分留在细胞质中发挥与天然免疫相关的功能,其余部分进入细胞核内发挥转录功能,并最终在细胞核内经过蛋白酶体系统降解。
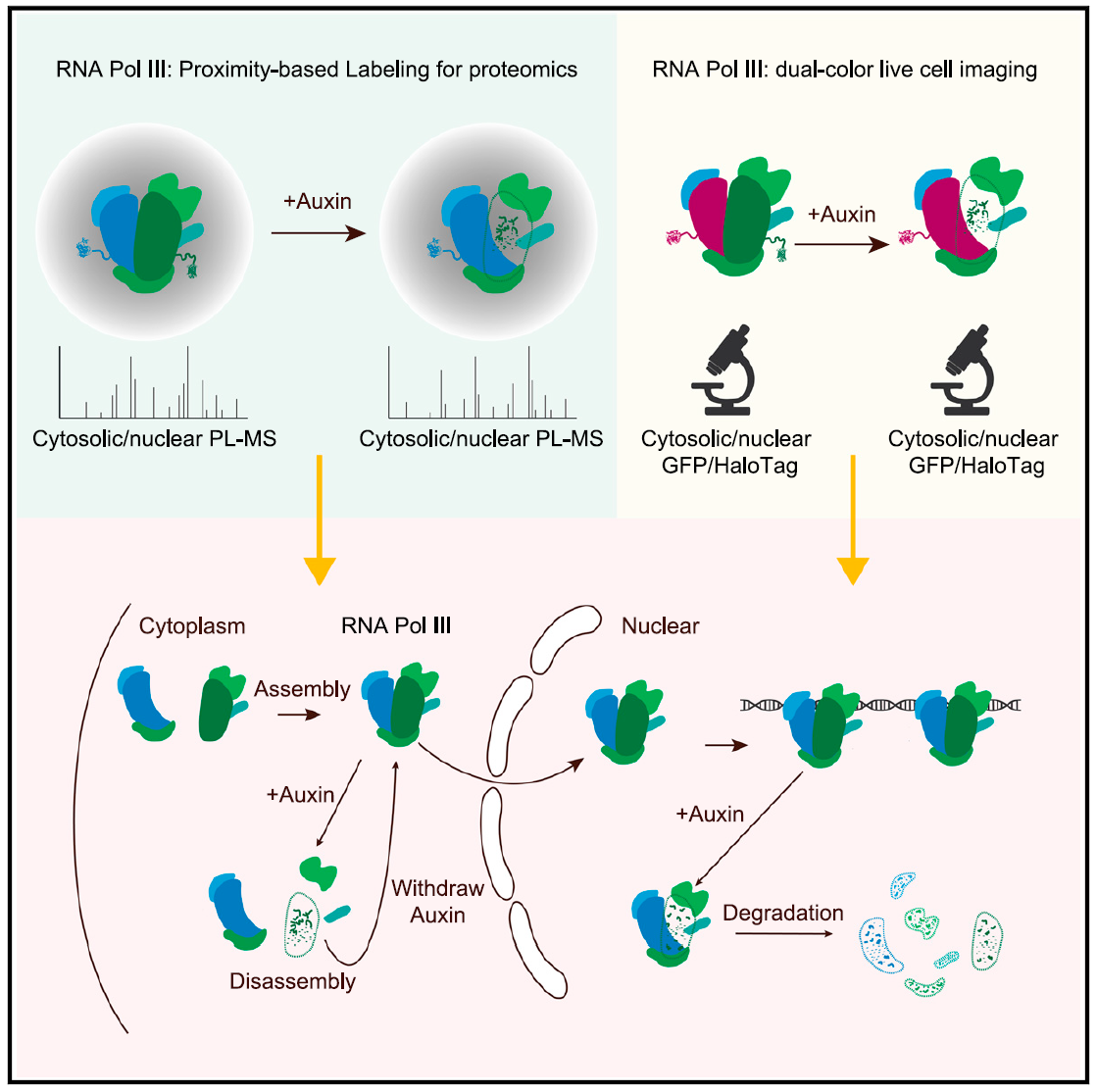
通过瞬时降解联合活细胞标记的方法,揭示了亚细胞定位在决定RNA聚合酶III命运中的作用
季雄为该论文的通讯作者。生命科学学院博士后田凯(已出站)、博士后王蕊和黄捷为该论文的共同第一作者。北京大学生命科学学院王辉博士(已出站,现为四川农大副教授)为该工作提供了重要帮助。该工作得到北大-清华生命科学联合中心、启东创新基金、细胞增殖与分化教育部重点实验室、科技部国家重点研发计划、国家自然科学基金和中国博士后科学基金的资助。感谢北京大学凤凰工程多个仪器平台对本项目的大力支持。
季雄课题组长期从事RNA聚合酶非经典功能调控研究。主要集中在RNA聚合酶亚基未知功能调控、分子探针和非模式生物等方向,近5年成果发表在Cell(2023)、Molecular Cell(2022,2023)、Genome Biology(2020,2022)、Nature Communications(2022)、Nucleic Acids Research (2023)、Cell Reports (2023)、Cell Discovery(2020)、CMLS(2022)、iScience(2022)、Transcription (2023)、STAR Protocol(2023a, 2023b)等杂志上,为选择性基因表达调控提供新的假说。现因发展需要,课题组招聘博士后1—2名。
参考文献
1. White, R. J. (2011). Transcription by RNA polymerase III: more complex than we thought.Nature Reviews Genetics,12(7), 459-463.
2. Liu, S., Hua, Y., Wang, J., Li, L., Yuan, J., Zhang, B., ... & Kong, D. (2021). RNA polymerase III is required for the repair of DNA double-strand breaks by homologous recombination.Cell,184(5), 1314-1329.
3. Chiu, Y. H., MacMillan, J. B., & Chen, Z. J. (2009). RNA polymerase III detects cytosolic DNA and induces type I interferons through the RIG-I pathway.Cell,138(3), 576-591.
4. Ablasser, A., Bauernfeind, F., Hartmann, G., Latz, E., Fitzgerald, K. A., & Hornung, V. (2009). RIG-I-dependent sensing of poly (dA: dT) through the induction of an RNA polymerase III–transcribed RNA intermediate.Nature immunology,10(10), 1065-1072.