
-

生物通官微
陪你抓住生命科技
跳动的脉搏
周璐教授课题组报道调控HIF-1α转录活性新机制
【字体: 大 中 小 】 时间:2023年07月06日 来源:复旦大学药学院
编辑推荐:
近日,复旦大学药学院周璐教授课题组发现了一种调控HIF-1α转录活性的新机制,相关工作以“Adamantaniline Derivatives Target ATP5B to Inhibit Translation of Hypoxia Inducible Factor-1α”为题在线发表于《先进科学》(Advanced Science)杂志
维持细胞内氧稳态是保证机体正常生命活动的必要条件。2019年William G. Kaelin Jr, Sir Peter J. Ratcliffe和Gregg L. Semenza因发现细胞是如何感受并适应胞内氧含量而获得诺贝尔生理或医学奖,而缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是细胞感受氧气变化的重要调控因子。HIF-1α在肿瘤细胞中普遍高表达,当其转录活性受到抑制时,肿瘤的生长明显减缓,且临床上HIF-1α高表达的患者预后较差,因此HIF-1α被认为是一个具有潜力的抗肿瘤靶,发现HIF-1α相关的新型调控机制并开发高效、低毒的HIF-1α小分子抑制剂具有挑战性和研究意义。
近日,复旦大学药学院周璐教授课题组发现了一种调控HIF-1α转录活性的新机制,相关工作以“Adamantaniline Derivatives Target ATP5B to Inhibit Translation of Hypoxia Inducible Factor-1α”为题在线发表于《先进科学》(Advanced Science)杂志。

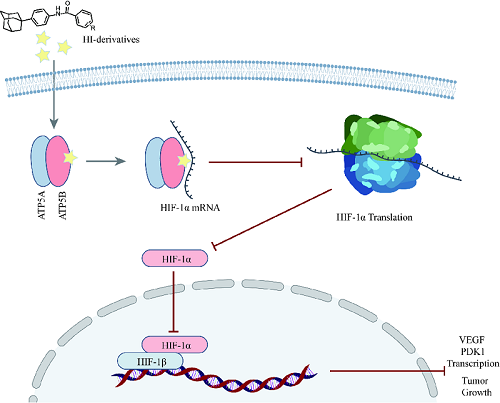
周璐教授团队利用构建的新型双荧光素酶活性测定体系进行基于表型的高通量筛选,得到了一类抑制HIF-1α转录活性的金刚烷苯胺类化合物。通过结构优化和化学合成,获得了活性高、毒性小的探针分子HI-102;利用探针分子通过基于亲和力的蛋白质组分析技术(affinity-based protein profiling,ABPP)识别并确认其作用靶点为ATP合酶的β亚基(ATP5B);借助敲低、敲入、荧光偏振、免疫荧光等方法进行了靶点验证和作用机制研究,揭示了该类化合物通过以ATP合酶非活性依赖的方式促进亚基ATP5B与HIF-1α的mRNA的结合,进而抑制HIF-1α翻译和转录活性,最终抑制肿瘤的生长。
复旦大学药学院博士生李慧逖与中国科学院上海营养与健康研究所刘亚利是该论文的共同第一作者,上海交通大学医学院徐颖副研究员和复旦大学药学院周璐教授为该论文通讯作者,该研究同时得到了上海交通大学医学院附属仁济医院陈国强院士和上海交通大学医学院附属第九人民医院曹禹研究员的大力支持。该研究工作得到了国家重点研发计划、国家自然科学基金、上海市科委基础研究特区计划、CAMS医学科学创新基金等项目资助。
原文链接:https://doi.org/10.1002/advs.202301071