编辑推荐:
该研究成果以“Identification of Histone Lysine Acetoacetylation as aDynamic Post-Translational Modification Regulated byHBO1”为题于北京时间6月29日在线发表于Advanced Science杂志

细胞代谢为生命过程提供能量,同时代谢物可共价修饰蛋白质来发挥信号传导功能。虽然许多代谢物在代谢通路中的作用广为人知,但它们介导细胞信号调控的功能仍有待探索。酮体(包括丙酮,乙酰乙酸和β-羟基丁酸)为脂质代谢产物,在葡萄糖缺乏的状态下,肝脏产生的酮体可以用作多种组织的替代能源,与多种病理生理状态密切相关。芝加哥大学赵英明教授团队和中国科学院上海药物研究所黄河课题组前期合作研究揭示β-羟基丁酸驱动的赖氨酸β-羟基丁酰化修饰(Kbhb)可能介导多个重要细胞进程,并鉴定了Kbhb的调控酶及底物谱。然而,作为类似的酮体代谢产物乙酰乙酸,其非代谢功能及相关的分子机制尚未明确。
基于上述科学问题,黄河课题组与赵英明教授团队、韩国成均馆大学Sangkyu Lee教授团队合作,鉴定了一种由乙酰乙酸驱动形成的全新组蛋白修饰—赖氨酸乙酰乙酰化(Kacac),并揭示了该新型修饰的关键调控因子HBO1。该研究成果以“Identification of Histone Lysine Acetoacetylation as aDynamic Post-Translational Modification Regulated byHBO1”为题于北京时间6月29日在线发表于Advanced Science杂志。
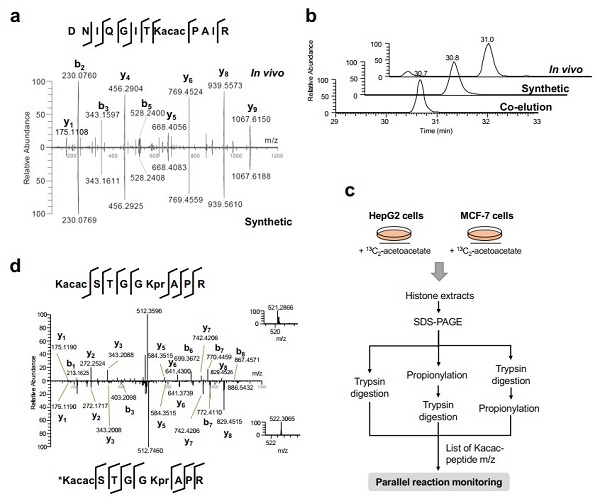
研究团队假设并验证了短链脂肪酸乙酰乙酸可以作为赖氨酸乙酰乙酰化修饰(Kacac)的前体。运用生物大分子高分辨质谱、稳定同位素标记以及免疫学等多种手段,科研人员鉴定并验证了组蛋白Kacac修饰在人、小鼠、斑马鱼的细胞中广泛存在。
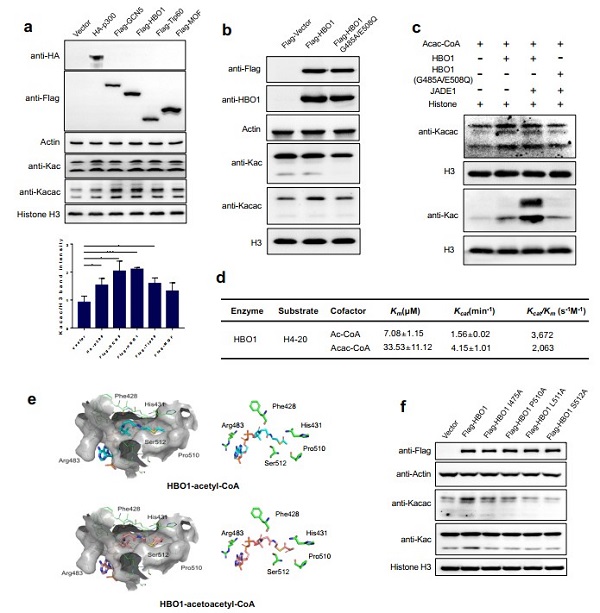
进一步的细胞和体外水平实验证实了HBO1可以催化Kacac,表明了HBO1是Kacac的“Writer”。另一方面,研究人员通过对HDAC1-11进行筛选,发现HDAC3具有去除Kacac的催化活性, 表明HDAC3是赖氨酸Kacac的“Eraser”。
随后,研究团队发现通过乙酰乙酸乙酯(EAA)和酮体生成抑制剂处理细胞可以动态调节Kacac修饰水平。通过深入的Kacac组学分析,该研究在哺乳动物组蛋白上成功鉴定到了33个独特的Kacac位点,描绘了组蛋白Kacac在物种和器官之间的底物谱。对Kacac修饰底物的进一步分析揭示了酮体的非代谢功能。
该研究首次揭示了一种全新的蛋白修饰类型Kacac,探索了调控Kacac的关键酶,拓展了Kacac调控的蛋白质底物谱,阐释了Kacac参与细胞代谢调控进程的新机制、新途径,为进一步揭示Kacac修饰在各种生理、病理条件下的作用提供了理论依据。
Sangkyu Lee教授、赵英明教授和黄河研究员为本文的共同通讯作者。庆北大学 Yan Gao,芝加哥大学Xinlei Sheng、 SunJoo Kim和上海药物所谭豆豆为本文的共同第一作者。本研究得到了韩国国家研究基金(NRF)、美国国立卫生研究院、国家自然科学基金和上海市科技重大项目的基金资助。
图1、赖氨酸乙酰乙酰化的鉴定
图2、HBO1催化乙酰乙酰转移酶活性
(供稿部门:黄河课题组;供稿人:严聪)
娑撳娴囩€瑰宓庢导锔炬暩鐎涙劒鍔熼妴濠団偓姘崇箖缂佸棜鍎禒锝堥樋閹活厾銇氶弬鎵畱閼筋垳澧块棃鍓佸仯閵嗗甯扮槐銏狀洤娴f洟鈧俺绻冩禒锝堥樋閸掑棙鐎芥穱鍐箻閹劎娈戦懡顖滃⒖閸欐垹骞囬惍鏃傗敀
10x Genomics閺傛澘鎼isium HD 瀵偓閸氼垰宕熺紒鍡氬劒閸掑棜椴搁悳鍥╂畱閸忋劏娴嗚ぐ鏇犵矋缁屾椽妫块崚鍡樼€介敍锟�
濞嗐垼绻嬫稉瀣祰Twist閵嗗﹣绗夐弬顓炲綁閸栨牜娈慍RISPR缁涙盯鈧鐗哥仦鈧妴瀣暩鐎涙劒鍔�
閸楁洜绮忛懗鐐寸ゴ鎼村繐鍙嗛梻銊ャ亣鐠佹彃鐖� - 濞e崬鍙嗘禍鍡毿掓禒搴n儑娑撯偓娑擃亜宕熺紒鍡氬劒鐎圭偤鐛欑拋鎹愵吀閸掔増鏆熼幑顔垮窛閹貉傜瑢閸欘垵顫嬮崠鏍掗弸锟�
娑撳娴囬妴濠勭矎閼崇偛鍞撮摂瀣鐠愩劋绨版担婊冨瀻閺嬫劖鏌熷▔鏇犳暩鐎涙劒鍔熼妴锟�



 生物通微信公众号
生物通微信公众号

