
-

生物通官微
陪你抓住生命科技
跳动的脉搏
张凌娟教授课题组揭示脂肪在皮肤发育和伤口愈合过程中可塑性变化...
【字体: 大 中 小 】 时间:2023年06月26日 来源:细胞应激生物学国家重点实验室(厦门大学)
编辑推荐:
2023 年 6 月,厦门大学细胞应激生物学国家重点实验室张凌娟教授课题组在 Cell Reports 发表研究论文 “Dynamic interplay between IL1 and WNT pathways in regulating dermal adipocyte lineage cells during skin development and wound regeneration”
真皮脂肪细胞具有高度可塑性,能响应不同外界刺激快速扩增或萎缩,参与调控伤口愈合、抵御细菌感染、毛发生长等多种重要皮肤生理过程,但是脂肪细胞的分化或去分化的细胞分化轨迹和分子调控机制还不清楚。
2023年6月,厦门大学细胞应激生物学国家重点实验室张凌娟教授课题组在Cell Reports发表研究论文“Dynamic interplay between IL1 and WNT pathways in regulating dermal adipocyte lineage cells during skin development and wound regeneration”。该研究使用多种转基因小鼠模型,结合不同年龄皮肤和伤口组织的小鼠单细胞转录组测序大数据分析和原代细胞功能验证等手段,首次定义了皮肤中脂肪谱系细胞的异质性,并揭示了皮肤脂肪细胞在伤口中的分化和去分化的途径和调控网络,发现脂肪分化和脂解再分化过程是受IL1-pCREB 和WNT-β catenin通路动态调控的。

该研究通过对不同年龄小鼠皮肤进行单细胞转录组测序,获得了多个真皮成纤维细胞(dermal fibroblast,dFB)亚群,对dFB的异质性进行了详细分析,发现了一群特殊的皮下间质区脂肪祖细胞(hypodermal interstitium adipocyte progenitor,HI-AP),发现该HI-AP细胞具有多向分化潜能,并发现WNT和IL1是真皮脂肪分化的主要抑制和促进信号,明确了IL1信号能通过激活NFKB-CREB通路并抑制WNT-β catenin通路活性,促进皮肤脂肪细胞分化的作用机制。
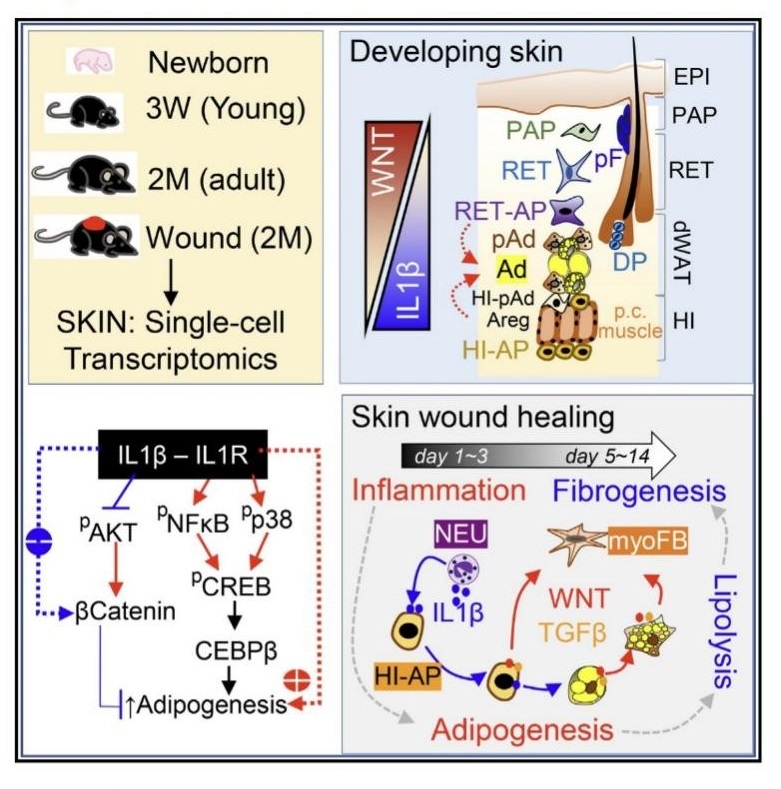
该研究还进一步构建了成体小鼠背部皮肤伤口模型,通过脂肪谱系荧光示踪和单细胞转录组分析等手段,明确了伤口中脂肪细胞从祖细胞新生并进而向肌成纤维细胞转分化的细胞轨迹,发现HI-AP细胞群是脂肪细胞和肌成纤维细胞的重要来源,而肌成纤维细胞是伤口重塑的主力军。在脂肪细胞中抑制GSK3或特异性敲除Gsk3,能有效促进TGFβ介导的脂肪细胞脂解,并向肌成纤维细转分化,促进伤口愈合中的纤维化反应。但是肌成纤维细胞的过度累积会导致增殖性疤痕的形成,因此该研究最后通过对瘢痕疙瘩Keloid病人样本的转录组和组化分析,发现瘢痕疙瘩组织中缺失IL1和脂肪新生通路活性,并富集过度活化的WNT-β catenin通路,这可能是导致Keloid中脂肪生成受阻、瘢痕过度增生的潜在新机制。
皮肤是人体最大的器官,同时也是保护人体免受外界伤害的最重要的一条防线,因此,伤口及时有效地快速完成修复,是保证人体不受外界有害病菌入侵的重要前提。伤口修复是一个复杂的过程,包含了多细胞、多因子的互相协作,肥胖/衰老的个体伤口修复能力减弱,容易形成溃疡并引发败血症,而过度的伤口修复则会形成疤痕。
真皮脂肪细胞作为新发现的一类白色脂肪细胞类型,具有多种重要的非代谢功能,对于维持皮肤的稳态和健康具有重要作用。张凌娟教授课题组多年来一直致力于皮肤脂肪新机制探索的相关研究,2015在Science发文首次报道皮肤脂肪具有分泌抗菌肽抑制金黄色葡萄球菌感染的能力,2019年在Immunity发文揭示TGFβ信号调控皮肤脂肪的老化和抗菌能力的改变,2021年在Science Translational Medicine发文指出肥胖后过度堆积的成熟脂肪细胞是致使皮肤免疫力低下的重要原因。本研究结果进一步揭示了脂肪在皮肤发育过程中的分化轨迹和调控机制,还展示了成体脂肪祖细胞和脂肪细胞在皮肤伤口修复过程中具有高度可塑性,能通过分化和去分化,促进真皮再生,但是,如果这一过程失调,可能会导致瘢痕形成,再一次让我们认识到皮肤脂肪的多样性和潜在的无限可能性。该研究不仅揭示了皮肤伤口修复失调的新机制,也为皮肤脂肪的新功能、新角色添加了崭新的内容,扩宽了我们对皮肤脂肪的认识,为将来以脂肪干细胞和皮肤脂肪为创新性靶点治疗疾病提供崭新的希望!
该论文的共同第一作者为博士后孙礼祥和博士生张小薇,通讯作者为张凌娟教授。项目得到了国家重点研发计划干细胞重点专项、国家自然科学基金、中国博士后科学基金项目等多个项目的支持,该研究还得到了福建医科大学附属第一医院皮肤科纪超团队、加州大学圣地亚哥分校皮肤医学系Rirchard L. Gallo团队和加州大学尔湾分校干细胞专家Maksim Plikus团队的协助。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00658-7