
-

生物通官微
陪你抓住生命科技
跳动的脉搏
药物所贺玖明团队研发空间多组学新技术揭示胃癌相关细胞特异的代谢重编程与互作
【字体: 大 中 小 】 时间:2023年06月09日 来源:北京协和医学院
编辑推荐:
2023年5月10日 , 中国医学科学院药物研究所贺玖明与齐鲁工业大学(山东省科学院)孙成龙、北京大学肿瘤医院季加孚/步召德、上海市生物医药技术研究院戴文韬等合作 , 在 Nature Communications (《自然 ? 通讯》) 杂志上在线发表 了题为 “Spatially resolved multi-omics highlights cell-specific metabolic remodeling and interactions in gastric cancer”(空间分辨多组学揭示胃癌相关细胞特异的代谢重编程与相互作用) 的 研究论文, 在空间分辨多组学 新 技术 研 发 及 肿瘤代谢 交 互作用研究方面取得 重要 进展
2023年5月10日,中国医学科学院药物研究所贺玖明与齐鲁工业大学(山东省科学院)孙成龙、北京大学肿瘤医院季加孚/步召德、上海市生物医药技术研究院戴文韬等合作,在Nature Communications(《自然?通讯》)杂志上在线发表了题为“Spatially resolved multi-omics highlights cell-specific metabolic remodeling and interactions in gastric cancer”(空间分辨多组学揭示胃癌相关细胞特异的代谢重编程与相互作用)的研究论文,在空间分辨多组学新技术研发及肿瘤代谢交互作用研究方面取得重要进展。
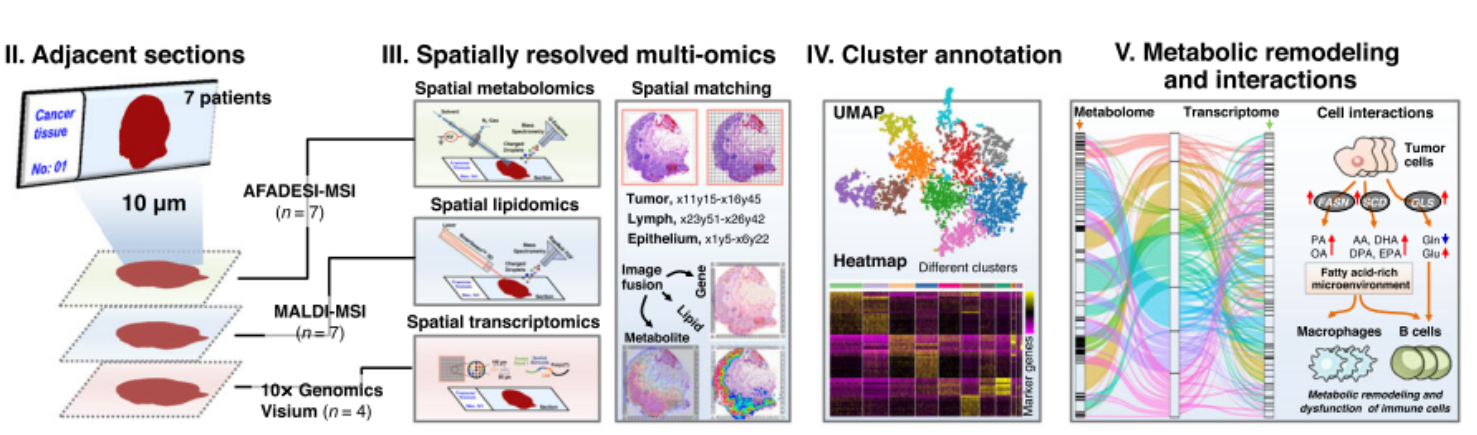
近年来,组学技术的发展极大地推动了人们对肿瘤的认识和临床精准诊治。然而,基于组织匀浆或单细胞解离的组学分析技术会破坏组织中细胞和分子所处的空间位置,无法获得高异质性肿瘤组织(微环境)中的分子和细胞的分布及相互作用信息。在前期自主研发的空间代谢组学技术的基础上,进一步整合空间脂质组学和空间转录组测序技术,在同一肿瘤组织样本的相邻切片上,实现了肿瘤组织微区中代谢组、脂质组和转录组数据的原位精准联合分析;并鉴别细胞种类,构建代谢物/脂质和上游调控基因的关联网络,实现了肿瘤组织微环境中肿瘤细胞、免疫细胞和基质细胞等代谢调控及交互作用的原位表征,为肿瘤代谢的深入研究提供了创新的有效方法、工具和新视角。
进一步对临床术后胃腺癌组织进行了空间多组学分析,发现胃癌肿瘤细胞中精氨酸和脯氨酸代谢、磷脂合成及代谢、脂肪酸生物合成等通路在代谢和转录水平上均发生了显著的异常改变;发现肿瘤细胞的氧化磷酸化代谢水平发生逐渐上调,下游代谢物如磷酸化葡萄糖、苹果酸、琥珀酸、组胺、硫苷酯等分子随着胃癌的进展发生持续变化;尤其发现了一个富含免疫细胞的狭长“肿瘤边界区域”,该区域中免疫细胞发生了代谢重编程,相比正常组织中的免疫细胞,其谷氨酰胺代谢、多不饱和脂肪酸表达都显著上调,提示肿瘤免疫屏障(逃逸)可能与谷氨酰胺代谢和多不饱和脂肪酸代谢密切相关。这些各类细胞特异的代谢重编程在胃癌的发生发展和免疫逃逸等过程中发挥重要作用,有望成为肿瘤精准治疗的潜在靶点。
齐鲁工业大学(山东省科学院)孙成龙研究员、北京大学肿瘤医院王安强副教授、药物所硕士生周晏合为本文共同第一作者。药物所贺玖明研究员、北京大学肿瘤医院季加孚教授、步召德教授和上海市生物医药技术研究院戴文韬副研究员为本文的共同通讯作者。本研究受到国家自然科学基金、中国医学科学院医学与健康科技创新工程(2022-I2M-2-001)、山东省泰山学者计划等项目的资助。
论文链接:https://www.nature.com/articles/s41467-023-38360-5