
-

生物通官微
陪你抓住生命科技
跳动的脉搏
长链非编码RNA介导的核仁组装调控组蛋白表观遗传修饰的关键机制
【字体: 大 中 小 】 时间:2023年05月22日 来源:中国科学技术大学 | 生命科学与医学部
编辑推荐:
2023 年 5 月 18 日,中国科学技术大学刘强团队在 Nature Structural & Molecular Biology 杂志上在线发表了题为 Nucleolus assembly impairment leads to two-cell transcriptional repression via NPM1-mediated PRC2 recruitment 的文章,解析了长链非编码 RNA-LoNA 如何参与核仁三层结构的组装,调控组蛋白 H3K27 的甲基化修饰,从而参与早期胚胎发育过程的关键分子机制

核仁是哺乳动物细胞核内最大的一个复杂且高度动态变化的无膜细胞器,其主要功能是形成成熟的核糖体,参与蛋白质的翻译过程。核仁具有三层结构,分别被称为纤维中心(Fibrillar center,FC),致密纤维组分(Dense fibrillar component,DFC)以及颗粒组分(Granular component,GC)【1】。核仁的结构组装以及完整性对于许多生物学过程具有重要意义,例如在衰老的细胞中,核仁会发生增大和“碎裂”现象【2】。在大脑的学习记忆过程中,核仁会发生增大现象【3】。虽然发现核仁已有两百多年,但是对核仁结构如何实现精细组装的过程依然不清楚。
2023年5月18日,中国科学技术大学刘强团队在Nature Structural & Molecular Biology杂志上在线发表了题为Nucleolus assembly impairment leads to two-cell transcriptional repression via NPM1-mediated PRC2 recruitment 的文章,解析了长链非编码RNA-LoNA如何参与核仁三层结构的组装,调控组蛋白H3K27的甲基化修饰,从而参与早期胚胎发育过程的关键分子机制。揭示了核仁结构组装过程与组蛋白表观遗传的调控关系。

中国科学技术大学刘强教授课题组长期从事非编码RNA以及RNA结合蛋白在中枢神经系统中的调控作用,迄今取得了系列重要研究成果(Neuron, 2021; Nature Communications, 2018; Cell Reports, 2019; Mol Neurodegeneration, 2021)。值得一提的是,长链非编码RNA-LoNA是刘强团队首先在核仁中发现并命名的。刘强课题组之前的研究表明,LoNA通过结合NCL和FBL蛋白,在核仁内分别参与调控rRNA转录和甲基化两个过程, 调控核糖体的水平,特别是远端突触的核糖体水平,参与神经突触蛋白翻译,影响大脑学习记忆过程【4】。刘强团队在继续深入探究LoNA如何调控核仁再组装过程的关键机制,阐明了LoNA和其介导的核仁组装在胚胎发育过程中的关键作用。
在这篇最新的Nature Structural & Molecular Biology论文中,研究人员首先发现LoNA敲除小鼠会发生胚胎致死现象。进一步研究发现LoNA敲除会直接导致胚胎发育停滞在二细胞阶段(two-cell arrest)。研究人员利用超高分辨显微技术(STORM)和透射电镜技术(TEM)发现核仁GC层在LoNA敲除的二细胞中发生显著“弥散”现象,表明核仁GC层组装失败。随后,研究人员通过RNA-pull down和蛋白质谱的方法鉴定了LoNA的结合蛋白FBL和NPM1,它们分别是核仁亚区域DFC和GC两个层的关键组成蛋白。研究人员发现LoNA可以显著促进FBL和NPM1蛋白的相变过程,从而促进核仁的组装。LoNA缺失会导致核仁组装失败,NPM1被释放到核基质,在乙酰转移酶p300催化下发生乙酰化修饰变成乙酰化NPM1蛋白(acNPM1)。acNPM1可以结合DNA并招募PRC2复合物【5】,催化H3K27的三甲基化修饰,从而抑制基因的转录。
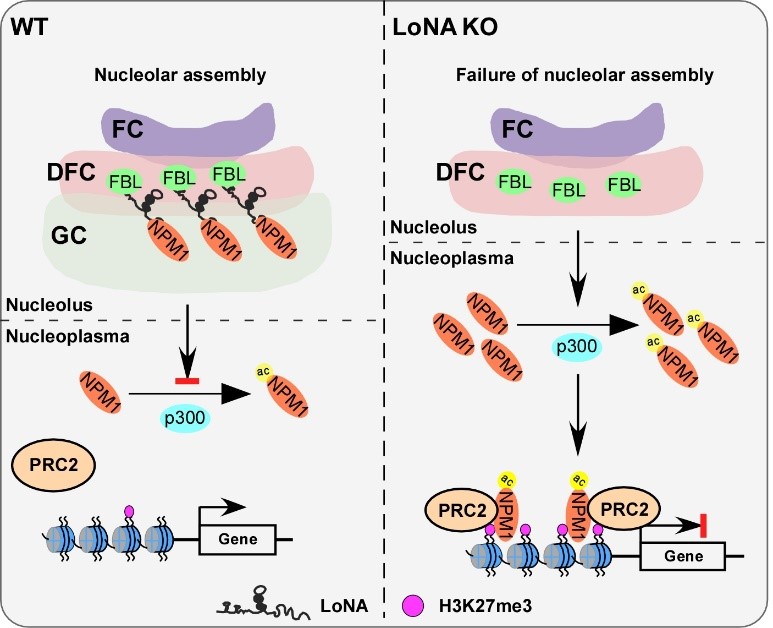
综上,这项研究揭示了长链非编码RNA可以通过调控核仁蛋白质相分离特性促进核仁结构的组装过程,抑制组蛋白H3K27me3修饰,进而参与基因的转录激活,影响胚胎发育过程。该项研究对长链非编码RNA领域,核仁结构组装过程与组蛋白表观遗传的深入研究具有重要意义。
中国科学技术大学特任副研究员李定丰为论文的第一作者,刘强教授为论文的通讯作者。本研究也得到了中国科学技术大学唐爱辉教授的大力帮助。
原文链接:
https://doi.org/10.1038/s41594-023-01003-w
参考文献:
1. Lafontaine, D. L. J., Riback, J. A., Bascetin, R., & Brangwynne, C. P. (2021). The nucleolus as a multiphase liquid condensate. Nature reviews. Molecular cell biology, 22(3), 165–182.
2. Li, Y., Jiang, Y., Paxman, J., O'Laughlin, R., Klepin, S., Zhu, Y., Pillus, L., Tsimring, L. S., Hasty, J., & Hao, N. (2020). A programmable fate decision landscape underlies single-cell aging in yeast. Science, 369(6501), 325–329.
3. Qü, M., Lü, Z., & Zilles, K. (1994). Aging of nucleolar organizer region in rat basal forebrain neurons related to learning and memory. Annals of anatomy, 176(1), 39–43.
4. Li, D., Zhang, J., Wang, M., Li, X., Gong, H., Tang, H., Chen, L., Wan, L., & Liu, Q. (2018). Activity dependent LoNA regulates translation by coordinating rRNA transcription and methylation. Nature communications, 9(1), 1726.
5. Laugesen, A., H?jfeldt, J. W., & Helin, K. (2019). Molecular Mechanisms Directing PRC2 Recruitment and H3K27 Methylation. Molecular cell, 74(1), 8–18.
下载安捷伦电子书《通过细胞代谢揭示新的药物靶点》探索如何通过代谢分析促进您的药物发现研究
10x Genomics新品Visium HD 开启单细胞分辨率的全转录组空间分析!
 生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
