
-

生物通官微
陪你抓住生命科技
跳动的脉搏
周海兵课题组在新型双机制雌激素受体降解剂药物研究取得新进展
【字体: 大 中 小 】 时间:2023年05月17日 来源:武汉大学药学院
编辑推荐:
新闻网讯( 通讯员药轩 )5月12日,武汉大学药学院/中南医院药学研究院周海兵课题组在国际药学TOP期刊 Acta Pharmaceutica Sinica B(IF=14.907)上发表题为“Discovery of novel covalent selective estrogen receptor degraders against endocrine-resistant breast cancer”的研究论文
新闻网讯(通讯员药轩)5月12日,武汉大学药学院/中南医院药学研究院周海兵课题组在国际药学TOP期刊Acta Pharmaceutica Sinica B(IF=14.907)上发表题为“Discovery of novel covalent selective estrogen receptor degraders against endocrine-resistant breast cancer”的研究论文。博士研究生王禹博、邓湘萍、冯甜及湖北大学生命科学学院闵鉴副教授为论文共同第一作者。武汉大学周海兵、董春娥教授及湖北大学郭瑞庭教授为该论文共同通讯作者。
乳腺癌目前跃居女性癌症首位,成为威胁女性健康的头号杀手。乳腺癌患者中约70%表现为雌激素受体α(ERα)阳性。因此,ERα是乳腺癌传统内分泌治疗的一个重要靶点。尽管内分泌疗法在治疗初期使雌激素受体阳性乳腺癌患者受益,但在长期内分泌治疗压力下将导致获得性内分泌耐药。目前,内分泌耐药是乳腺癌临床治疗面临极具挑战性问题。雌激素受体突变介导的非配体依赖活性是导致内分泌耐药的常见机制,以氟维司群(Ful)为代表的选择性雌激素受体降解剂(SERDs)药物通过降解靶蛋白雌激素受体以关闭其信号传导,从而克服由靶蛋白突变等原因造成的耐药性问题。氟维司群是目前临床唯一使用的ERα降解剂药物,但由于其较差的药代动力学性质而限制了其临床使用效果;另一方面,共价修饰是解决靶蛋白结合域氨基酸突变导致耐药的另一重要策略,通过与结合域特定氨基酸形成共价键来解决配体结合力弱、效力低等问题,但目前以共价策略设计的选择性雌激素受体共价拮抗剂H3B-6545仍处于临床II期,并且该候选药物对雌激素受体没有降解能力。因此,针对内分泌耐药乳腺癌,开发新型共价选择性雌激素受体降解剂(cSERD)药物极具重要意义。
在该研究中,作者通过基于结构的药物设计策略并结合结构生物学研究,构建了靶向ERα共价降解剂小分子化合物库。对共价弹头和关键药效团的构效关系研究发现,化合物的29c在ERα野生型(MCF-7, T-47D),突变型(T-47DD538G,T-47DY537S)以及他莫昔芬耐药型(LCC-2)多种乳腺癌细胞表现出优于他莫昔芬和氟维司群的抗增殖活性,以及优于氟维司群的最大降解能力(图1)。
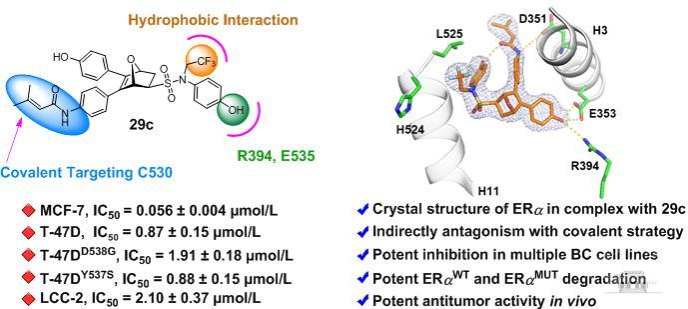
图1新型共价雌激素受体降解剂29c
共价降解剂29c、雌二醇(E2)以及共价拮抗剂H3B-6545与ERα复合物晶体结构研究表明,29c通过共价靶标半胱氨酸C530和与螺旋H11的强烈疏水性相互作用破坏了ERα蛋白的稳态,从而形成独特的间接拮抗剂构象并推动了ERα的降解。此外,Intact-Mass质谱技术确认了化合物29c共价弹头与C530形成共价键连接,进一步验证了29c独特性的双重作用机制及设计的合理性(图2)。
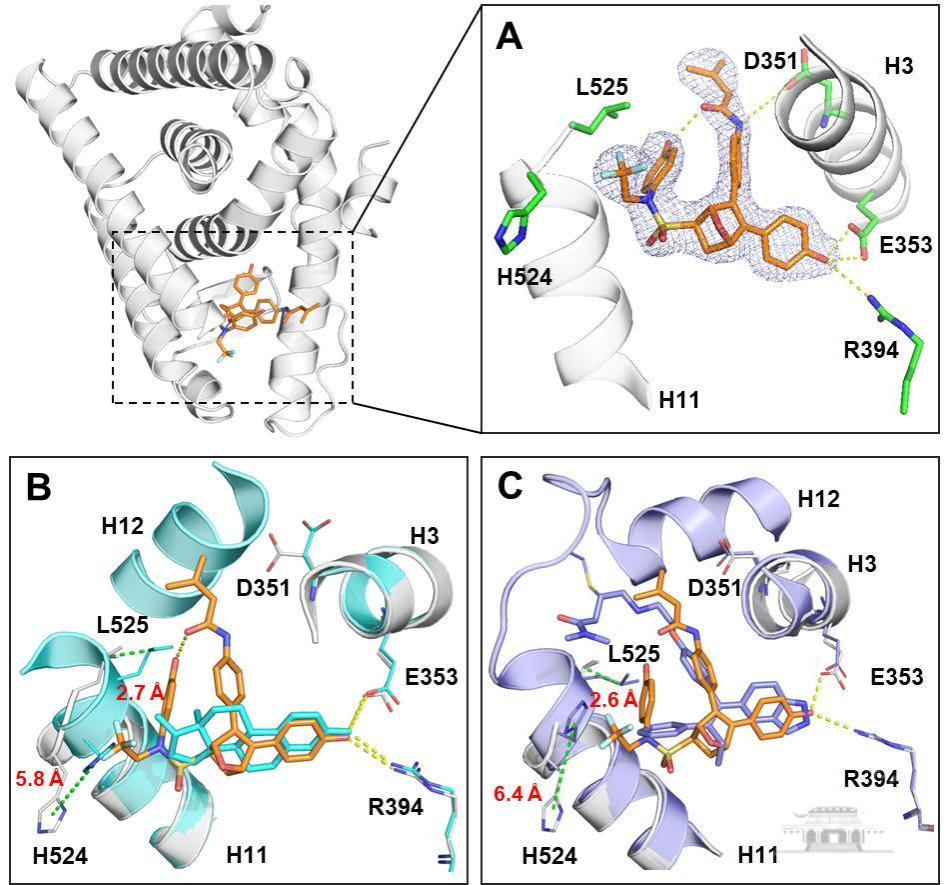
图2(A)29c-ERα晶体复合物(PDB:7YMK);(B)29c-ERα与E2-ERα晶体叠加图;(C)29c-ERα与H3B-5942-ERα晶体叠加图
通过对29c在雌性裸鼠(MCF-7)动物模型中进行了体内药效学评估,结果显示,与空白对照组相比,化合物29c体内抗肿瘤活性呈剂量依赖性,在相同剂量下明显优于阳性对照药物他莫昔芬,并且与氟维司群相当。同时29c对小鼠体重无明显影响,表明其具有低毒性。该研究证明了双机制共价cSERDs为解决乳腺癌内分泌疗法的耐药性问题提供了新思路。
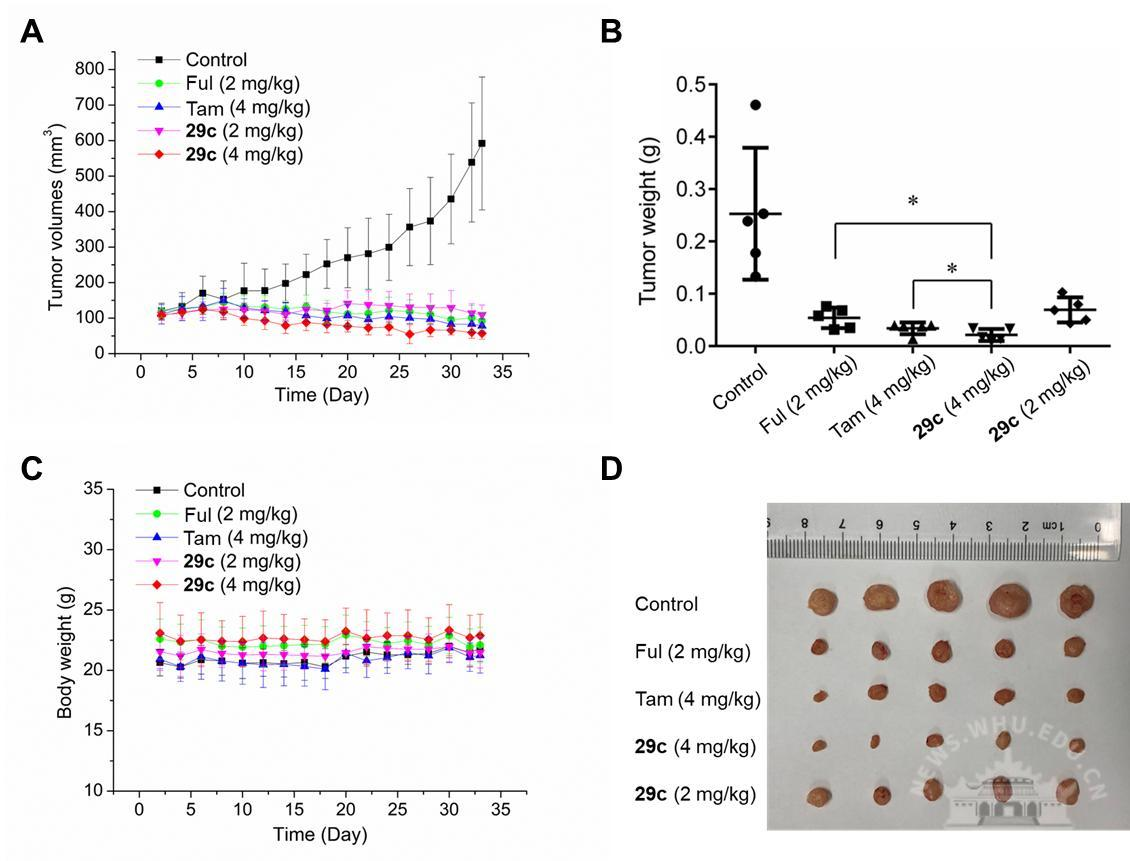
图3阳性对照药及29c在MCF-7动物模型中的抗肿瘤活性
该研究得到国家重点研发计划、国家自然科学基金面上项目、病毒学国家重点实验室和教育部免疫与代谢前沿科学中心的支持。
论文链接:
https://www.sciencedirect.com/science/article/pii/S221138352300151X
(编辑:付晓歌)