
-

生物通官微
陪你抓住生命科技
跳动的脉搏
抑制胰腺导管腺癌自噬和线粒体功能的生物学串扰
【字体: 大 中 小 】 时间:2023年05月06日 来源:Science Advances
胰腺导管腺癌(PDAC)细胞保持高水平的自噬或降解,使它们能够在严格限制的微环境中茁壮成长。然而,自噬促进胰腺癌细胞生长和存活的过程尚不清楚。
在《Science Advances》上发表的一篇新报告中,Subhadip Mukhopadhyay和纽约大学和哈佛大学的放射肿瘤学和基因组稳定性研究小组展示了抑制自噬如何改变PDAC患者的线粒体功能。他们通过实验减弱线粒体中琥珀酸脱氢酶复合体铁硫亚基,以限制不稳定铁池的可用性。
与依赖巨噬作用的其他肿瘤类型相比,癌细胞系使用自噬来维持铁稳态。生物学家注意到癌症相关的成纤维细胞如何为胰腺癌细胞提供生物可利用的铁来抵抗自噬的消融。Mukhopadhyay及其同事在小鼠模型中给予低铁饮食,以自噬抑制治疗的形式阻止这种串扰。这些结果强调了自噬、铁代谢和线粒体功能之间的关键联系,以驱动胰腺导管腺癌的进展。
胰腺导管腺癌占对治疗高度耐药且5年生存率低的胰腺癌的95%以上,其中癌症相关死亡人数占美国第二高的比率。这些肿瘤被定义为恶劣、低灌注和缺氧的微环境,营养物质的可用性改变。癌细胞可以通过重新编程其代谢需求,依靠巨噬和巨噬作用等营养清除机制来生存和生长,从而在恶劣环境中生存。先前的研究强调了铁蛋白自噬(一种选择性自噬形式)的作用及其在维持铁稳态中的作用。
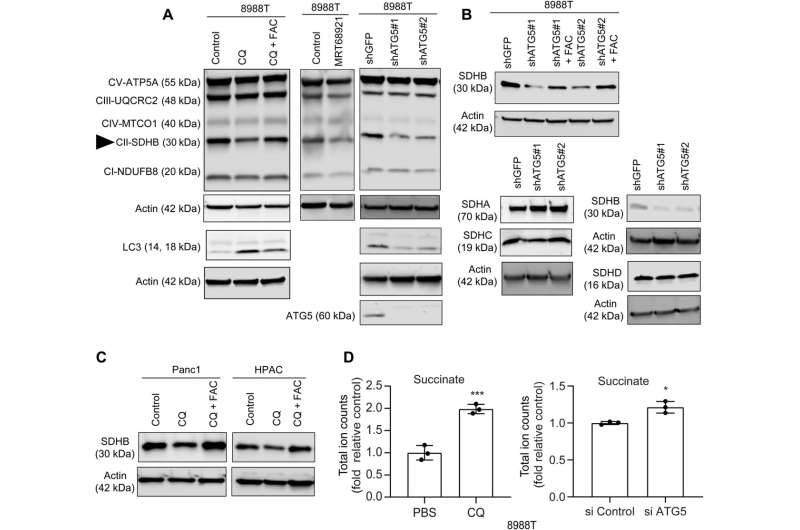
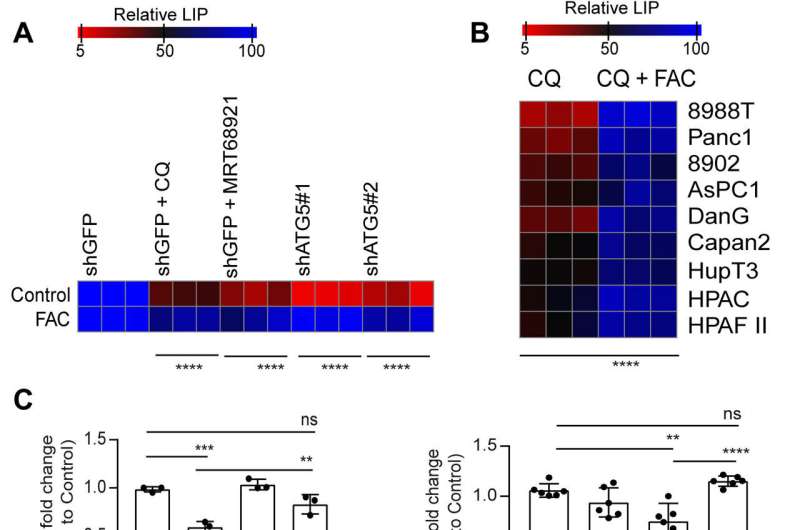
在这项工作中,Mukhopadhyay和他的团队展示了抑制自噬如何减少铁硫簇的组装,以稳定各种蛋白质,包括那些参与电子转移链的蛋白质,如琥珀酸脱氢酶复合物铁硫亚基B (SDHB)。胰腺癌细胞自噬过程中该分子的减少导致线粒体呼吸减少和嵴微结构的重组。补充铁或表达异位SDHB均能恢复生长,改善线粒体缺陷。
此前,Mukhopadhyay及其同事展示了胰腺癌细胞系的自噬抑制如何导致线粒体耗氧量下降。然而,他们无法确定这种损伤的机制。先前的研究表明,除了半胱氨酸水平下降外,氨基酸库在自噬抑制下保持不变。
然而,向胰腺癌细胞补充半胱氨酸并没有改变氧气消耗的缺陷率,这表明一条直接影响线粒体的途径。虽然铁硫簇蛋白驱动线粒体功能,但自噬抑制后不稳定铁池的下降降低了线粒体呼吸,研究小组通过补充柠檬酸铁铵恢复了线粒体呼吸。自噬的抑制进一步导致琥珀酸脱氢酶复合体铁硫亚基B (SDHB)蛋白水平的降低,突出了线粒体蛋白的功能丧失。
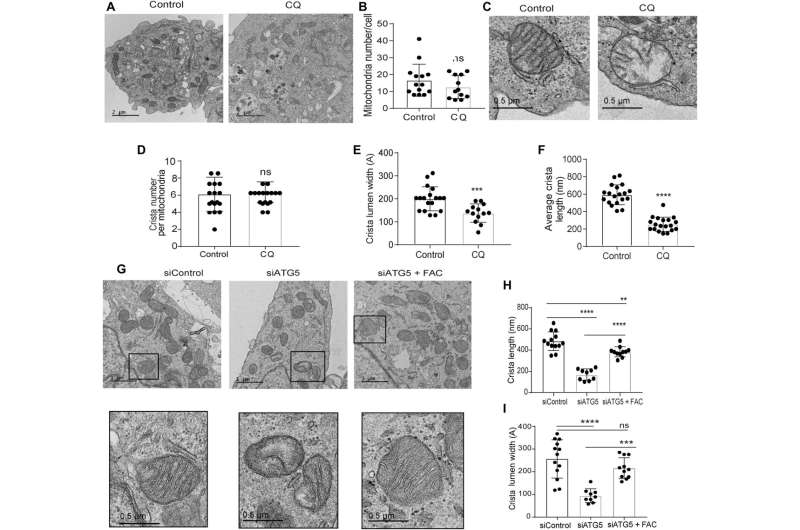
研究小组利用透射电子显微镜揭示了自噬缺陷胰腺癌细胞的线粒体结构;通过服用氯喹而起作用。他们注意到,治疗后线粒体嵴管腔明显减少,并伴有较大的空腔,这表明功能缺陷。
该团队展示了SDHB蛋白的异位表达如何恢复嵴微结构。事实上,SDHB的过表达挽救了自噬抑制后的增殖和耗氧速率。他们研究了这些成分在胰腺癌细胞自噬丧失后,在铁和硫蛋白的生物发生过程中发挥重要作用的机制。
虽然自噬可以调节胰腺癌细胞中铁的可用性,但患者对羟氯喹单药治疗的反应在临床上不足以减轻疾病。为了研究肿瘤微环境对这种耐药性的影响,研究人员研究了通过将胰腺癌细胞与癌症相关成纤维细胞共培养以重建微生理肿瘤环境来补偿不稳定铁池的效果。
研究人员研究了细胞间的串扰,以了解细胞对不稳定铁池的调节,并检测了关键铁转运蛋白的表达。他们注意到,在与自噬抑制的胰腺癌细胞一起培养的成纤维细胞中,输出铁蛋白增加。当他们使用Tocilizumab时,他们在共培养系统中恢复了自噬抑制对癌细胞系的抗增殖作用。
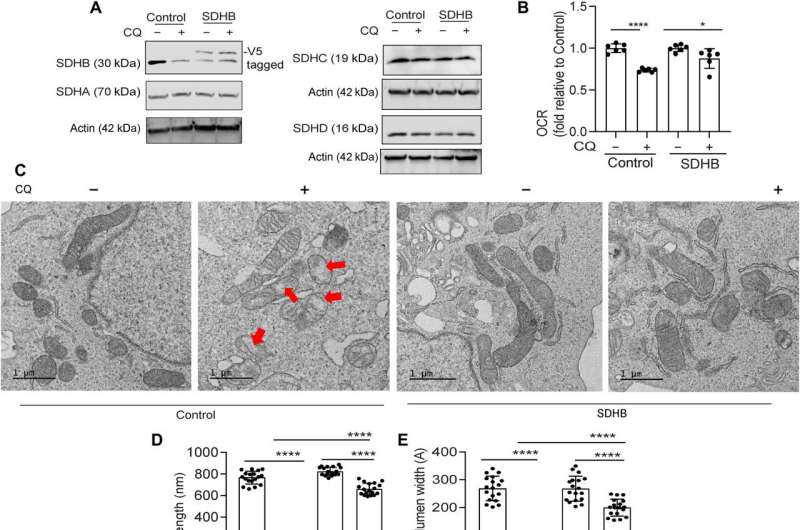
Mukhopadhyay及其同事探索了治疗癌症的方法,并探讨了自噬抑制是否可以促进铁限制来抑制胰腺肿瘤的生长。他们降低了生物可利用铁,从而破坏了胰管腺癌细胞和癌症相关成纤维细胞之间的串扰。他们通过将小鼠暴露在低铁饮食中两周,然后在小鼠宿主中移植带有多西环素诱导的显性载体和对照载体的癌细胞,从而系统地降低了小鼠体内的铁水平。虽然饮食中的铁水平不影响血红蛋白水平,但自噬抑制显著降低肿瘤生长。低铁饮食进一步降低肿瘤生长,表明缺铁使肿瘤细胞敏化,进行自噬抑制。
限铁饮食和自噬的结合降低了肿瘤中亚铁的生物可利用浓度,同时降低了琥珀酸脱氢酶复合体铁硫亚基B的表达。当科学家们单独使用氯喹时,它不能减少老鼠体内肿瘤的生长,尽管氯喹和铁限制饮食结合使用能显著减少肿瘤的生长。综合数据表明,低铁饮食与自噬抑制一起严重破坏胰腺导管腺癌肿瘤中的铁稳态。
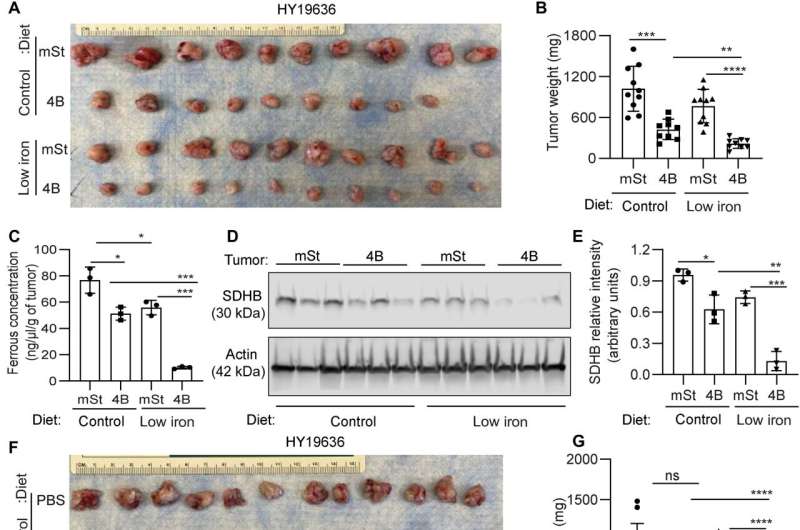
通过这种方式,Subhadip Mukhopadhyay及其同事确定了胰管腺癌肿瘤在疾病进展过程中如何依赖自噬生长和进化。自噬抑制降低了不稳定铁池和铁硫团簇的合成。他们在培养物中添加铁,促进铁硫簇和琥珀酸脱氢酶复合体铁硫亚基B (SDHB)蛋白的异位表达,以恢复线粒体功能和细胞生长。在胰腺癌细胞中,自噬是维持铁稳态和支持线粒体功能所必需的,这是生长和增殖所必需的。
研究人员解剖了肿瘤与间质之间发生的多种代谢交叉对话,探讨了胰管腺癌细胞铁代谢的破坏及其对复杂肿瘤微环境的影响。这些机制的发现将有助于开发新的设计方法来靶向胰管腺癌细胞中的铁代谢过程。