
-

生物通官微
陪你抓住生命科技
跳动的脉搏
我国学者在驱动肿瘤发生和转移的表观遗传机制研究方面取得进展
【字体: 大 中 小 】 时间:2023年04月11日 来源:国家自然科学基金委员会
编辑推荐:
研究成果以“N6-甲基腺苷对HRAS的表观转录调控驱动肿瘤进展(Epitranscriptic Regulation of HRAS by N6-methyladenosine Drives Tumor Progression)”为题,于2023年3月30日在线发表于《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)杂志
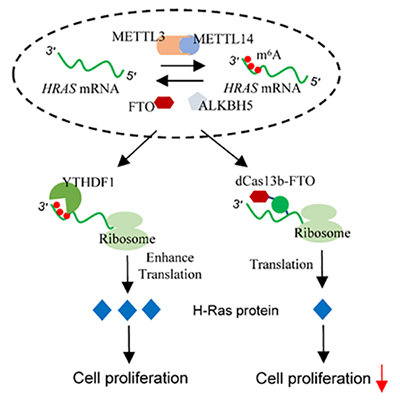 |
图 HRAS m6A修饰调控肿瘤细胞命运
在国家自然科学基金项目(82203348、82103230、82025029、82150114)等资助下,东南大学高山教授课题组在驱动肿瘤发生和转移的表观遗传机制研究方面取得进展。研究成果以“N6-甲基腺苷对HRAS的表观转录调控驱动肿瘤进展(Epitranscriptic Regulation of HRAS by N6-methyladenosine Drives Tumor Progression)”为题,于2023年3月30日在线发表于《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)杂志。原文链接:https://www.pnas.org/doi/10.1073/pnas.2302291120。
RAS基因是第一个被鉴定的人类致癌基因,该基因家族包括3种功能型基因:HRAS、NRAS和KRAS。既往针对Ras的研究主要聚焦于其基因突变或蛋白稳定性调控肿瘤发生和转移的分子机制。转录后修饰是表观遗传机制的重要环节,m6A修饰是真核生物RNA最主要的转录后修饰,其功能失调与包括癌症在内的多种疾病密切相关。RAS基因家族是否具有m6A修饰位点,以及m6A修饰如何调控RAS基因的肿瘤驱动功能尚未见报道。
该研究基于肿瘤组织m6A修饰图谱,发现HRAS的3'UTR区存在3个m6A修饰位点,主要受去甲基化酶FTO调控,并可被YTHDF1蛋白阅读,从而提高H-Ras蛋白表达,促进肿瘤细胞增殖和转移。使用dCas13b-FTO和dCas13b-ALKBH5去甲基化系统特异性去除HRAS的m6A修饰后,H-Ras蛋白表达受到抑制,肿瘤细胞的增殖和转移能力也显著降低(图)。
该研究解析了HRAS的表观转录调控在驱动肿瘤发生发展中的重要作用与机制,为靶向Ras的肿瘤精准治疗提供了新的理论基础和策略。