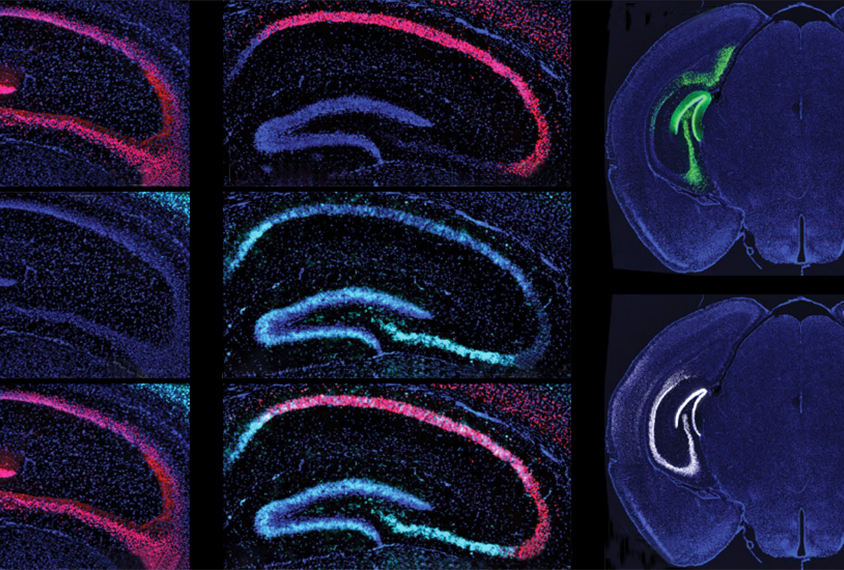
在神经元被刺激两小时后,DNA修复复合体中的蛋白质在小鼠大脑中表达。
大多数细胞在整个生命周期内都在复制和分裂时修复受损的DNA。但神经元不具备这种能力。神经元一旦成熟就会停止分裂,每次发送或接收信号时都会收集损伤。
根据2月15日发表在《Nature》杂志上的一项研究,为了帮助对抗破坏,神经元使用一种名为NuA4的DNA修复复合体的特殊版本。一些与自闭症相关的基因编码了这种复合物的某些部分,这表明DNA修复机制的破坏可能导致自闭症。
马里兰州贝塞斯达国家癌症研究所基因组完整性实验室主任Andre Nussenzweig说,这些发现有助于解释神经元如何处理似乎不可避免的DNA损伤。他没有参与这项工作。2015年,一个独立研究小组发现,神经元信号会导致启动子区域的双链DNA断裂,从而对大脑活动做出反应。
新的一系列小鼠实验表明,神经元通过NPAS4引发NuA4, NPAS4是一种调节神经元基因表达的蛋白质,以响应大脑活动。根据同一团队2021年的一项研究,一些对大脑活动做出反应的基因与自闭症密切相关。
NuA4复合物修饰染色质,细胞内DNA和蛋白质的复合物。染色质调节的中断有时可能导致自闭症。哈佛医学院神经生物学教授、首席研究员Michael Greenberg说,但这些监管机构的工作机制尚不清楚。“这项工作将与自闭症有关的染色质调节因子固定在特定的通路上,然后说,‘好吧,肯定有更多这样的东西。’”
Greenberg和他的团队长期以来一直想了解NPAS4在大脑中的作用。他们怀疑它与许多蛋白质相互作用,基于他们发现了一种类似的复合物,以FOS为中心,FOS是一种转录因子家族,与NPAS4一样,在出生后立即在大脑中活跃。他们首先从成年小鼠的大脑中提取含有NPAS4的蛋白质复合物。纯化分子的重量大约是NPAS4及其已知伙伴重量的6倍,这暗示着更多的相互作用有待发现。
这是一个非常关键的实验,使整个项目得以启动。
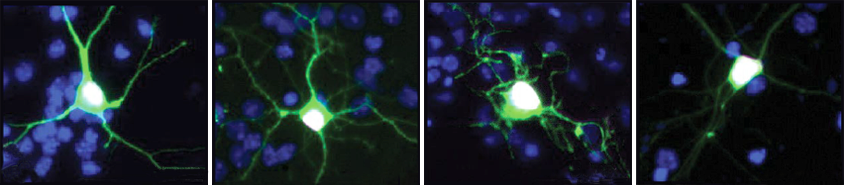
没有NPAS4,神经元无法修复某些类型的DNA损伤
在这些相互作用中,研究人员在刺激小鼠海马体中的神经元活动后发现,涉及NuA4复合体的蛋白质。其中一些基因,包括EP400、TRRAP和ACTL6B,与自闭症密切相关。
不过,Nussenzweig说,这并不能保证DNA修复的中断直接导致自闭症。“这个综合体还有其他作用。”
受刺激的神经元在与NPAS4结合的部分基因组中显示出γ-H2AX水平的增加,γ-H2AX是DNA断裂的标志。根据一种绘制DNA断裂图谱的方法,这种损伤主要集中在1500多个基因调控元件上,比如启动子和增强子。在刺激10小时后,野生型神经元中这种断裂的数量下降,但在缺乏NPAS4的神经元中没有-这表明NPAS4将NuA4复合体引导到需要修复的区域。
研究人员发现,随着小鼠年龄的增长,突变倾向于积聚在不受NPAS4约束的基因组部分。但与蛋白质结合的部位似乎不会受到这种损伤。缺乏NPAS4的小鼠大约在1岁时死亡,比野生型小鼠早1到2年。
根据一个独立团队2022年的一项研究,神经元每年至少会积累三次突变,主要是在启动子和增强子上。哈佛医学院(Harvard Medical School)儿科学和神经学教授、该论文的首席研究员Christopher Walsh说,损伤的来源似乎是神经元需要迅速解开DNA,以接触有助于细胞交流的基因。
Walsh说:“这些不同的研究似乎都趋同于这样一个事实:的确,当神经元去极化时,它们很快就会打开DNA,打开基因。必须有一个非常、非常有效的修复过程,才能把它重新组装起来。”
研究NPAS4-NuA4复合体对非典型大脑活动的反应可以阐明修复机制是如何与神经和神经发育状况联系在一起的,大急流市密歇根州立大学儿科和人类发育助理教授Daniel Vogt说,他没有参与这项工作。Vogt说,探测这种复合体在不同亚型神经元中的作用也很重要。
Greenberg说,他计划在来自人类干细胞的神经元中重复这项工作,并检查该成分的亚单位的作用。这项工作还可以帮助研究人员了解DNA损伤修复失败的影响。“现在我们有了这些持续损伤部位的很好的地图,我们可以提出更宏观的问题,关于这与突变积累有什么关系,特别是在人脑中。”




