
-

生物通官微
陪你抓住生命科技
跳动的脉搏
药事管理与临床药学系崔一民团队和药物化学系刘振明团队发现靶向整合素受体的前列腺癌潜在新疗法
【字体: 大 中 小 】 时间:2023年02月11日 来源:北京大学药学院
编辑推荐:
2023 年 2 月 10 日,北京大学药学院药事管理与临床药学系崔一民教授团队和药物化学系刘振明研究员团队合作 在 Nature 子刊 Signal Transduction and Targeted Therapy 杂志( Q1 区, IF = 38.104 )在线发表了题为 “Discovery of C19-9 as a novel non-RGD inhibitor of αvβ3 to overcome enzalutamide resistance in castration-resistant prostate cancer” 的研究论文,该研究发现了一类新型整合素受体抑制剂,有望成为克服恩杂鲁胺耐药的前列腺癌新疗法
2023年2月10日,北京大学药学院药事管理与临床药学系崔一民教授团队和药物化学系刘振明研究员团队合作在Nature子刊Signal Transduction and Targeted Therapy杂志(Q1区,IF = 38.104)在线发表了题为“Discovery of C19-9 as a novel non-RGD inhibitor of αvβ3 to overcome enzalutamide resistance in castration-resistant prostate cancer”的研究论文,该研究发现了一类新型整合素受体抑制剂,有望成为克服恩杂鲁胺耐药的前列腺癌新疗法。

前列腺癌是全球范围内男性第二大恶性肿瘤,随着人口老龄化的加剧,前列腺癌成为我国男性泌尿系统肿瘤之首,是近十年来增速最快的男性恶性肿瘤之一。根据我国国家癌症中心的数据,前列腺癌自2008年起成为男性泌尿系统中发病率最高的肿瘤,2020年我国前列腺癌新发病例数为11万,死亡人数超过5万,是美国的两倍,并且超过70%的前列腺癌患者确诊时已属于中晚期。目前中晚期前列腺癌的一线治疗方案仍为内分泌治疗,但经过中位时间为18-24个月的内分泌治疗,大部分患者进展为去势抵抗性前列腺癌。目前抗雄激素一线治疗药物恩杂鲁胺等均无法避免原发性或获得性耐药的产生,临床亟需新型前列腺癌治疗药物。
细胞粘附介导耐药在调控肿瘤入侵、干细胞表型及药物抵抗中具有重要作用。整合素是主要的细胞粘附分子受体,几乎参与肿瘤进展和转移的全过程。整合素αvβ3是整合素家族的重要成员,参与肿瘤的粘附、血管生成以及肿瘤亲器官性转移等过程。崔一民教授团队前期研究发现整合素αvβ3受体与细胞外基质相互作用介导前列腺癌抗雄激素药物治疗耐药(Pang, et al. Oxid Med Cell Longev, 2021; Pang, et al. Pharmacol Res, 2019, 2023)。在本研究中,基于虚拟筛选、表面等离子共振、微量热泳动、分子动力学模拟等技术发现了具有抗前列腺癌活性的高亲和力的新型αvβ3抑制剂—C19-9(图 1)。C19-9可以显著性抑制恩杂鲁胺耐药的前列腺癌细胞系及类器官增殖,抑制骨转移前列腺癌细胞系的迁移和粘附,并对肿瘤类器官诱导的血管新生具有显著性的抑制作用。
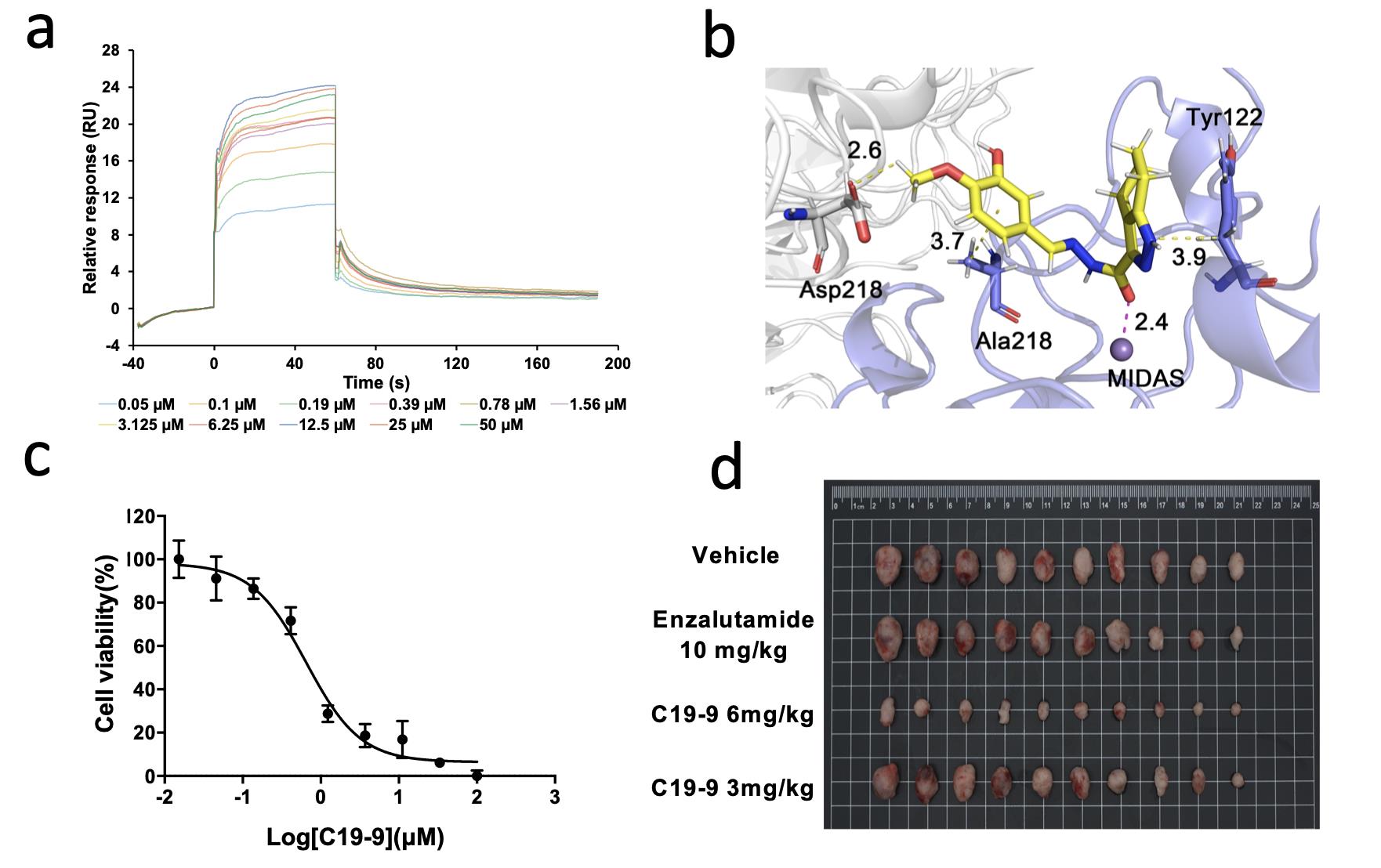
图 1. C19-9体内外成药效评价:a. 基于表面等离子共振技术测定C19-9与αvβ3的亲和力。b. 分子动力模拟研究C19-9与αvβ3相互作用。c. C19-9抑制前列腺癌类器官增殖。d. C19-9在TRAMP-C1去势抵抗性前列腺癌小鼠模型中的药效评价。
C19-9可以抑制细胞外基质与αvβ3相互作用,显著性抑制ERK1/2磷酸化,VEGFA分泌及EMT进展,并通过PI3K/AKT通路抑制AR表达,而且C19-9通过JAK/STAT3通路,抑制IDO表达,改善免疫抑制微环境(图 2)。药效评价和作用机制研究表明,C19-9的药效优于恩杂鲁胺,并且具有良好的安全性。结构新颖、高亲和力的αvβ3抑制剂C19-9对前列腺癌耐药及免疫抑制微环境的发生发展有明显抑制作用,有望成为前列腺癌的新型治疗药物。
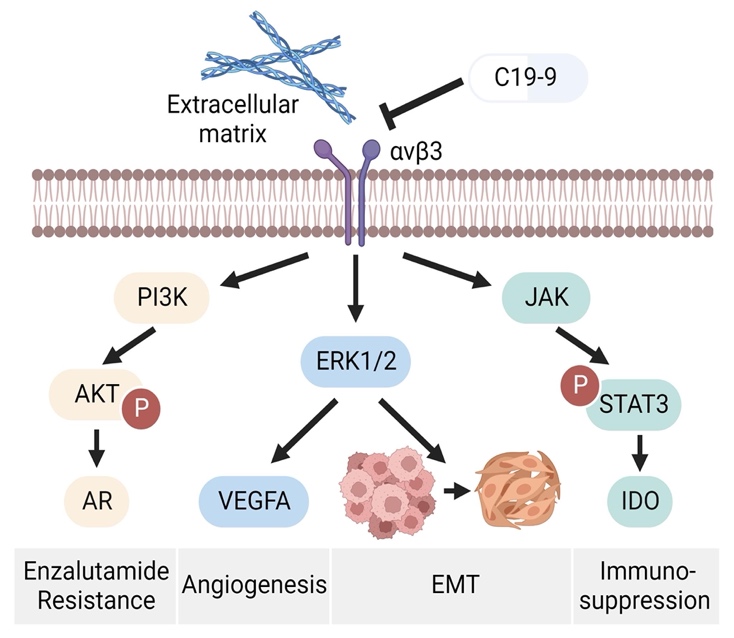
图 2. C19-9作用机制研究: C19-9通过阻断细胞外基质与αvβ3相互作用抑制下游信号通路,抑制前列腺癌恶性进展。
崔一民教授团队长期围绕泛血管重大疾病领域进行创新药物研发与评价,推动学科交融、实现协同创新,促进产学研一体化发展。刘振明研究员团队长期致力于新技术驱动的创新候选新药发现研究工作,推动AIDD/大数据、微阵列芯片于高通量筛选和时空药效评价等在内智慧创新药物发现技术的落地和应用。研究团队基于对临床治疗需求的精准把握及对创新药物药效学和临床评价关键指标的深刻理解,开展源于临床价值的新药研发,在靶点发现与确认、候选药物设计、成药性评价、新递送系统开发、临床评价等关键环节建成多个专优特新技术平台,形成全方位、全链条、全生命周期的新药研发与评价体系。
原文链接:https://www.nature.com/articles/s41392-022-01236-z
第一作者简介:

庞晓丛,药理学博士,北京大学第一医院副研究员,硕士生导师,从事临床药理及新药研发。担任国际基础与临床药理学联合会(IUPHAR)青年学者委员、中国药理学会临床药理学专业委员会青年委员会秘书长、北京药理学会理事、《中国临床药理学杂志》编委等。主持10余项国家级、省部级及院级科研项目,包括国自然面上基金、青年基金,北京市自然青年基金等。目前以第一作者或通讯作者在在国际权威杂志Signal Transduction and Targeted Therapy、JAMA Oncology、Pharmacological Research等发表高水平论文20余篇,授权国内专利2项,国际PCT专利1项。2019年入选中国科协和北京市科协青年人才托举工程。获得第三届首都医学创新与转化成果展示与科技评价活动一等奖,北京药理学、北京生理学会青年科学家论坛一等奖,北大医学首届创新转化大赛三等奖等。

孙晓娇,生物化学与分子生物学博士,北京大学药学院博士后,毕业于北京协和医学院,从事PDX及PDOX肿瘤模型构建和药效评价,主持或参与国家级及省部级项目3项,发表高水平论文3篇,申请专利6项,授权专利3项。

谷延伦,北京大学药学院临床药学专业在读硕士,2020年毕业于北京大学药学院,获理学学士学位,主要从事抗肿瘤新药发现及精准用药研究,参与国家级及省部级项目2项,发表高水平论文2篇,授权专利3项。
通讯作者简介:

崔一民,临床药理学博士(M.D&Ph.D),教授,主任药师,博士生导师。现任北京大学临床药理研究所所长,北京大学第一医院临床试验中心主任、药学部主任,北京大学药学院药事管理与临床药学系副主任。崔一民教授长期致力于创新药早期临床研究和国家新药审评技术转化研究,致力于建立全生命周期的药学服务与创新转化体系。崔一民教授作为首席专家主持十余项国家级、省部级课题。在国际权威杂志Nature Reviews Drug Discovery、JAMA Oncology、JACC、Signal Transduction and Targeted Therapy、APS-B等发表高水平论文近300篇,以主编或副主编身份参编多本临床药学和临床药理学专业书籍,担任《中国临床药理学杂志》执行主编,Journal of Clinical Pharmacy and Therapeutics(JCPT)主编。获中国药学会科学技术奖一等奖、吴阶平保罗杨森医学药学奖、药明康德生命化学研究奖学者奖、中国药学发展奖创新药物突出成就奖、科技部“创新人才推进计划”创新团队负责人。

刘振明,北京大学药学院研究员,药学化学和临床药学博士生导师。刘振明研究员作为课题负责人和主要成员参加和完成了包括国家自然科学基金、863计划、国家科技重大专项,国家科技重点研发计划,北京市自然科学基金等在内的21项国家科研项目。近五年在国内外主要学术期刊上发表研究论文>70篇。主持和参与完成教材和专著编写5部。申请和获得中国发明专利5项。获得中国药学会施维雅青年药物化学家奖,北京大学绿叶生物医药杰出青年学者奖,北京大学医学部优秀人才奖励计划青年学者奖等。
药事管理与临床药学系 供稿