
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命起源分子RNA可能成为人类癌症治疗的新靶点
【字体: 大 中 小 】 时间:2023年02月14日 来源:Nature Communications
编辑推荐:
本研究结果表明,在导致DNA断裂的治疗(如放疗)后,使用THZ1化合物和类似物抑制RNA合成可能会大大增加肿瘤细胞对死亡的敏感性。
RNA是一种孕育生命的分子,现在已被证明在修复人类遗传物质和防止致癌突变方面非常重要。近日,塞维利亚大学的Daniel Gómez Cabello研究团队在国际期刊《自然通讯》(Nature Communications)上发表了一篇题为“CtIP-dependent RNA expression flanking DNA breaks guides the choice of DNA repair pathway”的研究报告,他们发现这种化合物分子(RNA)可能是开发定制化癌症治疗策略的潜在治疗靶点。
RNA聚合酶是在细胞中产生RNA的机器。这对于安全可靠地修复人类DNA断裂至关重要。RNA的产生对健康细胞非常重要,但对肿瘤细胞更重要,因为肿瘤细胞需要这种酶的更多活性才能生长失控。本研究结果表明,在导致DNA断裂的治疗(如放疗)后,使用THZ1化合物和类似物抑制RNA合成可能会大大增加肿瘤细胞对死亡的敏感性。
研究人员以无偏倚的全基因组方式,对人类细胞照射5 Gy临床相关剂量后的RNA相关DSB修复事件进行了评估。电离辐射可以在转录活跃和沉默的基因组区域引起全球性的DNA损伤。DNA损伤后,RNA的整体转录活性受到抑制,ATM和内聚蛋白等因素参与了这一机制。他们表明,与未辐照的细胞相比,新生RNA的形成在60分钟后恢复,并在30分钟后增加,这可能是由于在DSB位点产生的新生RNA与转录活性基因组区域RNAPII的常规活性相结合,后者在很大程度上负责在模拟处理的细胞中检测到新生RNA。在照射后最初的30分钟内,DSB修复途径的选择已经完成,我们的研究结果表明,在这个过程中,RNAPII介导的DSB位点转录的主动调控是必要的。在DSB修复过程中主动生成的新生RNA与ssDNA切除束相关,这意味着在HR过程中新RNA的合成。
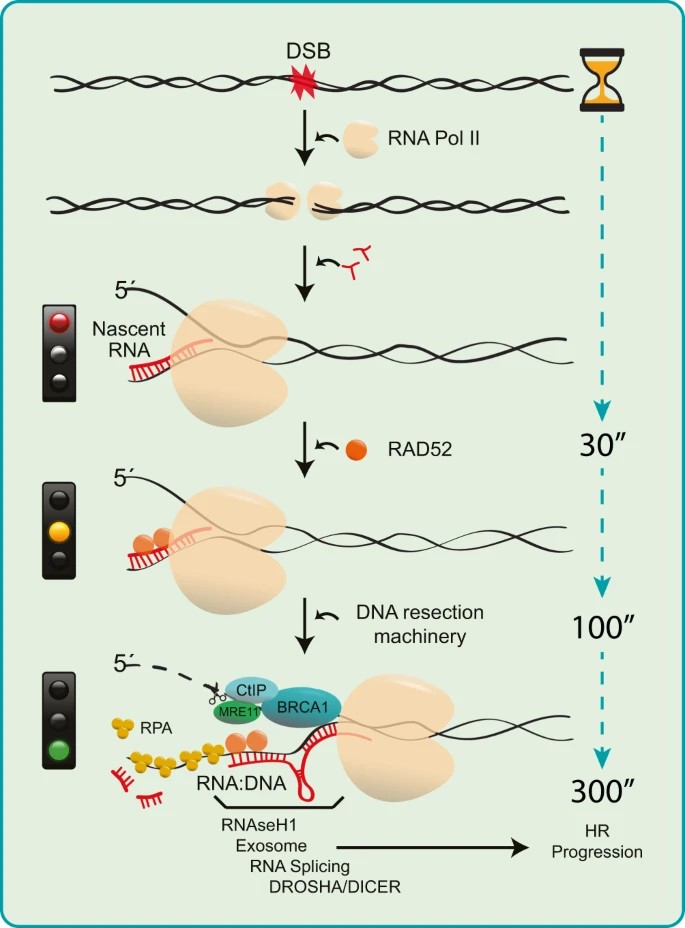
图1 RNAPII生成的新生RNA通过HR引导DNA末端切除和DSB修复的调控和作用的示意图模型。
此外,抑制RNA合成削弱了DSB附近RNA:DNA杂化的形成和HR修复。总之,新生的DSB侧RNA及其局部动态对于正确引导细胞决定通过可靠的HR途径修复潜在致命的DSB病变至关重要,从而维护内稳态并最大限度地减少包括癌症在内的病理发展。
研究员首席研究员表示,这项研究为如何改进常规治疗,实现更高的治疗成功率提供了基本线索。尽管在临床实践中使用这些RNA聚合酶抑制剂还有很长的路要走,但研究人员正在进行基于这种酶治疗癌症的临床试验。增加对如何更安全、更有针对性地使用这些化合物的了解,可能有助于研究人员尽可能地开发出人类癌症的新疗法。
现在,研究人员正在研究和分析RNA(使生命得以存在的原始分子)如何作为一种特殊工具来帮助治疗各种人类疾病。Diana Aguilar-Morante评论说:“一旦我们观察到选择性抑制RNA的产生可以增强癌细胞中的放疗效果,并且不会显著影响身体的其他细胞,我们将开始研究各种人类癌症,如胶质母细胞瘤和儿童神经母细胞瘤。在这一点上,我们的挑战将是提高这些新的RNA产生抑制剂的效率,并减少癌症患者的副作用,”Gómez-Cabello说。
Gómez-Cabello D, et al. CtIP-dependent nascent RNA expression flanking DNA breaks guides the choice of DNA repair pathway. Nature Communications, 2022, 13(1): 1-15.