
-

生物通官微
陪你抓住生命科技
跳动的脉搏
南京大学最新发文:DNA诱发异质核糖核蛋白A2/B1二聚化机制
【字体: 大 中 小 】 时间:2023年02月10日 来源:南京大学生命科学学院
编辑推荐:
该研究成果以“ Structural insight into hnRNP A2/B1 homodimerization and DNA recognition ”为题,于 2023 年 2 月 1 日发表在 Journal of Molecular Biology 上
先天免疫是宿主抵御病毒等微生物病原体的第一道防线。病毒核酸是一类重要的病原相关分子模式,宿主细胞质中存在一系列核酸感受器能够识别病毒核酸进而启动干扰素等免疫应答通路。但是部分DNA病毒,如单纯疱疹病毒和腺病毒等,可以直接将病毒DNA注入到宿主细胞核内进而逃避宿主细胞质中DNA感受器的识别。然而目前针对宿主细胞核内的DNA感受器的研究仍不够深入。
近期,异质核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoprotein A2/B1,hnRNP A2/B1)被鉴定为一种新型的细胞核内的DNA感受器,它能够识别细胞核内的病毒DNA并形成同源二聚体。hnRNP A2/B1同源二聚体是其易位到细胞质激活干扰素信号通路的先决条件。然而hnRNP A2/B1识别DNA以及形成同源二聚体的分子机制仍不清楚。
南京大学生命科学学院医药生物技术国家重点实验室籍晓云教授团队一直致力于病毒感染及其引起的宿主细胞先天性免疫应答的分子机制研究。近日,该团队通过X射线衍射技术获得了hnRNP A2/B1与单链DNA(ssDNA)复合物的晶体结构,并通过生化实验进一步证实DNA中的U型构象是诱导hnRNP A2/B1二聚化的关键,揭示了hnRNP A2/B1在抗病毒免疫以及其他细胞过程中的一种潜在功能(图1)。
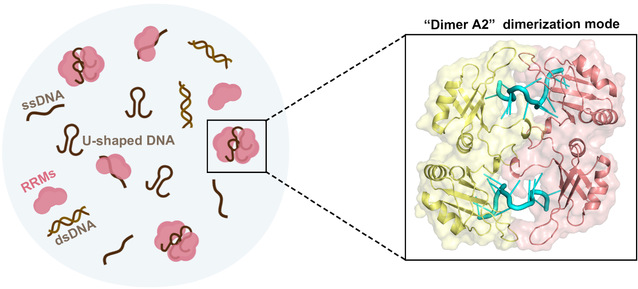
图1. DNA诱导hnRNP A2/B1二聚化的分子机制示意图
通过hnRNP A2/B1的核酸结合结构域(RRMs)与12 nt ssDNA复合物的高分辨率晶体结构,该团队人员首次发现一种独特的U型DNA构象能够介导hnRNP A2/B1形成全新的二聚化模式(图2A-B)。研究人员通过生化实验发现溶液中的hnRNP A2/B1能够结合具有U型结构的G-四链体ssDNA并形成蛋白质同源二聚体,而与线性ssDNA结合只能形成摩尔比例1:1的蛋白质核酸复合物(图2C-D)。此外,研究人员发现只有含有U型凸起的双链DNA(dsDNA)能与hnRNP A2/B1结合并诱发蛋白质二聚体的形成,缺乏凸起结构的dsDNA不能与hnRNP A2/B1结合(图2E-F)。这些结果表明DNA的U型构象在诱导hnRNP A2/B1二聚过程中发挥了关键作用。
RRM结构域是研究最广泛的核酸结合结构域之一。研究人员通过比对一系列RRMs与核酸复合物的三维结构发现了两种可能的稳定二聚体组合(图2G-H)。进一步的氨基酸突变实验表明,只有对在晶体结构中观察到的蛋白质二聚体界面进行突变才会影响溶液中hnRNP A2/B1同源二聚体的形成(图2I-J)。这证明溶液中的hnRNP A2/B1以晶体结构中呈现的二聚体模式(命名为“Dimer A2”模式)存在。
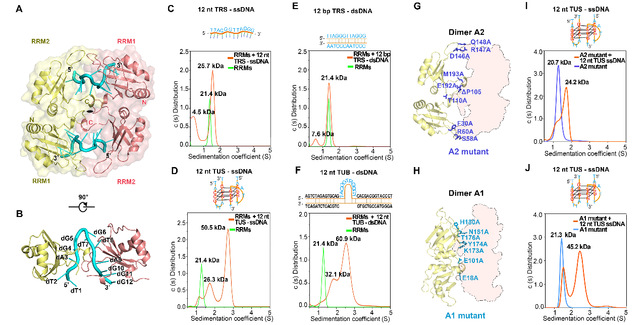
图2. DNA的U型构象诱导hnRNP A2/B1在溶液中形成“Dimer A2”同源二聚体
DNA独特的U型结构在病毒基因组和人类基因组如端粒中大量存在。该研究不仅提出了hnRNP A2/B1识别ssDNA或dsDNA中U型结构的一种全新的分子机制,也拓宽了对hnRNP A2/B1这一重要的DNA感受器在参与抗病毒免疫以及其他细胞过程中形成蛋白质同源二聚体模式的理解和认知。
该研究成果以“Structural insight into hnRNP A2/B1 homodimerization and DNA recognition”为题,于2023年2月1日发表在Journal of Molecular Biology上。南京大学生命科学学院博士研究生刘越和阿不都热依木·阿布拉博士为该论文的共同第一作者,南京大学生命科学学院籍晓云教授为该论文的通讯作者。该研究工作得到了国家重点研究计划和国家自然科学基金等项目的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S0022283622005460