
-

生物通官微
陪你抓住生命科技
跳动的脉搏
微生物代谢产物增强宿主抗病毒免疫反应的机制
【字体: 大 中 小 】 时间:2023年02月08日 来源:巴斯德所
编辑推荐:
2月 6 日,国际期刊 Nature Communications 在线发表了中国科学院上海巴斯德研究所孟广勋团队题为 “ Microbiota-derived acetate enhances host antiviral response via NLRP3 ” 的研究论文,该研究通过一系列体内和体外实验,揭示了流感病毒感染过程中 肠道菌群代谢产物乙酸盐通过NLRP3增强I型干扰素 的产生而 抵抗病毒感染的机制
2月6日,国际期刊 Nature Communications 在线发表了中国科学院上海巴斯德研究所孟广勋团队题为 “Microbiota-derived acetate enhances host antiviral response via NLRP3” 的研究论文,该研究通过一系列体内和体外实验,揭示了流感病毒感染过程中肠道菌群代谢产物乙酸盐通过NLRP3增强I型干扰素的产生而抵抗病毒感染的机制。

致病性病毒感染是人类健康面临的一个重大挑战。宿主对呼吸道病毒的免疫反应与菌群和微生物代谢密切相关。另外,宿主对甲型流感病毒(IAV)的防御涉及NLRP3炎症小体的激活,然而,NLRP3发挥保护功能的机制尚需深入解析。孟广勋课题组从Nlrp3-/-小鼠的肠道菌群中分离到一株假长双歧杆菌(Bifidobacterium pseudolongum) NjM1,该菌株能在野生型小鼠体内抵抗IAV感染。这种保护作用是由NjM1产生乙酸盐进而增强I型干扰素(IFN-I)的合成而实现的。在机制上,乙酸盐作用于受体GPR43后,NLRP3桥接GPR43和MAVS、促进MAVS的寡聚和下游信号,增强IFN-I产生。实验数据表明NLRP3能介导乙酸盐产生菌增强IFN-I诱导(图1),提示乙酸盐-GPR43-NLRP3-MAVS-IFN-I信号轴是对抗呼吸道病毒感染的一个潜在治疗靶点。
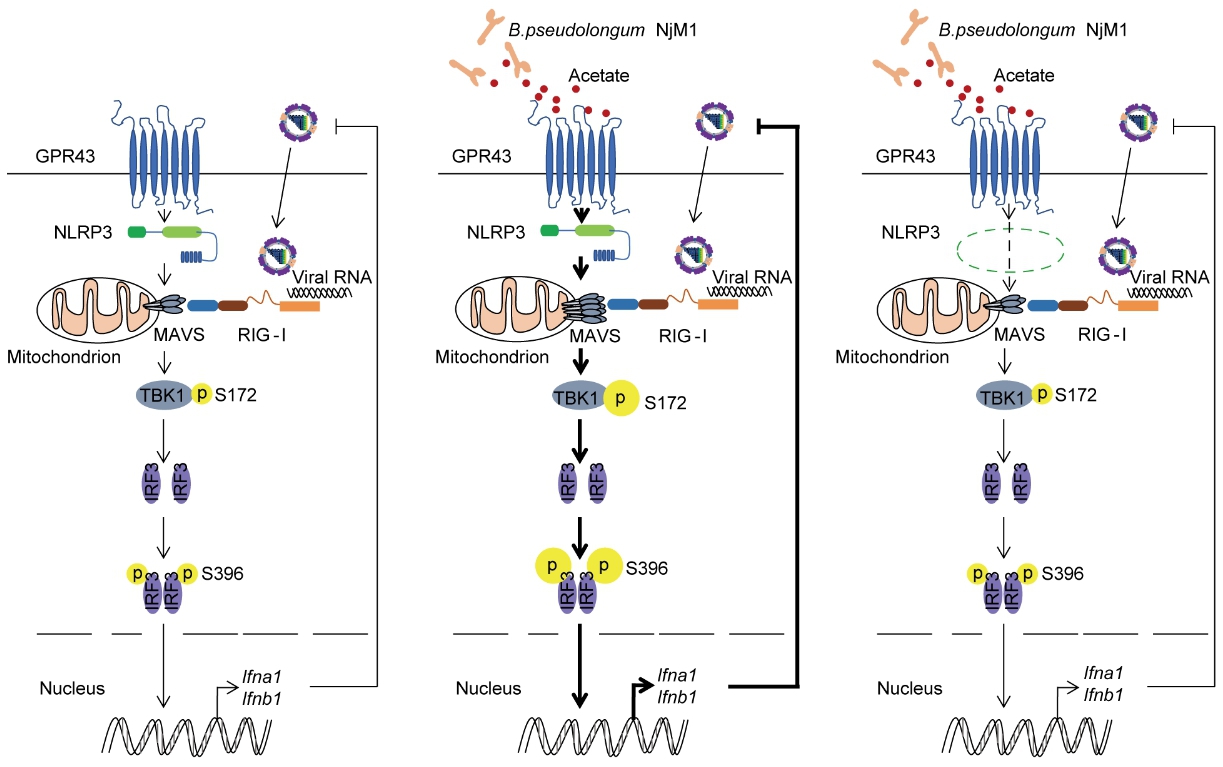
图1.NLRP3介导肠道菌代谢产物乙酸盐增强I型干扰素产生而抵抗病毒感染
中国科学院上海巴斯德所博士后牛俊领为该论文第一作者,中国科学院上海巴斯德所孟广勋研究员、上海交通大学生命科学技术学院微生物代谢国家重点实验室赵立平教授和张晨虹研究员为论文的共同通讯作者。该研究得到了国家自然科学基金、科技部重点研发计划、中科院先导和国际合作重点项目以及上海市市级科技重大专项、优秀学科带头人等项目支持。
原文链接:https://www.nature.com/articles/s41467-023-36323-4