
-

生物通官微
陪你抓住生命科技
跳动的脉搏
昆明植物所研究发现通过新颖结合模式靶向Cav3.2缓解疼痛的黄杨生物碱
【字体: 大 中 小 】 时间:2023年12月30日 来源:中国科学院昆明植物研究所
编辑推荐:
近日,该研究工作以Analgesic Buxus alkaloids with Enhanced Selectivity for the Low-Voltage-Gated Calcium Channel Cav3.2 over Cav3.1 through a New Binding Mode为题作为热点论文(Hot Paper)发表在国际著名期刊《德国应用化学》(Angew. Chem. Int. Ed. https://doi.org/10.1002/anie.202313461 )
T-型钙通道(T-type Calcium Channels,TTCCs;Cav3.1-3.3)是一类具有特殊生理功能的电压门控钙通道,在疼痛、癫痫及震颤症等药物研发中是重要的靶点。MERK、Neurocrine Biosciences、Jazz Pharmaceuticals及Cavion等制药公司均开展了TTCCs创新药物研发,以Z944、ABT-639、Suvecaltamide、MK-8998、CX-8998和NBI-827104为代表的合成分子也陆续进入了临床研究。然而,上述分子到目前为止无一获批上市,TTCCs药物研发面临巨大挑战。目前,TTCCs药物研发的一个需要突破的重要方向是解码新颖活性分子与TTCCs的相互作用模式,为亚型选择性活性分子的设计与研发提供结构基础(上述分子无亚型选择性,甚至在任意两个TTCCs通道中都没有明显的偏向性)。
黄杨属植物(Buxus spp),如黄杨(B. sinica)、小叶黄杨(B. microphylla)、雀舌黄杨(B. bodinieri)和锦熟黄杨(B. sempervirens)等是中国著名的观赏植物,深受文人墨客喜爱, 被喻为“木中君子”。同时,它们也有重要的药用价值。我国科学家成功将代表性黄杨三萜生物碱(BAs)环维黄杨星D(CVB-D)开发成了治疗心血管疾病的天然药物(商品名:黄杨宁)。前期,研究人员率先发现CVB-D通过抑制Cav3.2发挥广谱的缓解疼痛作用(Front Pharmacol. 2022, 13: 1081697),这进一步的发现激发了研究人员系统研究BAs的兴趣。
中国科学院昆明植物研究所膜蛋白(离子通道)天然药物研究人才组联合华中科技大学万落生团队对3种不同结构类型,共24个黄杨三萜生物碱展开了系统研究,发现9,19-cyclo-artane-类型分子2和3(包含CVB-D),以及9(10/19)abeo-artane-类型分子9和10均对Cav3.2有显著的抑制作用。有趣的是,2、3和CVB-D不具有TTCCs亚型选择性。化合物9和10在Cav3.2和Cav3.1中分别表现出了9倍和30倍的选择性,远远超过现有的抑制剂。值得指出的是10号分子对Cav3.2的抑制作用与在临床开展研究的阳性对照Z944相当。
为了探究这些分子与通道的结合模式,通过Cav3.1-Cav3.2嵌合体的构建及点突变实验发现Cav3.2中Domain III的S6上serine-1543残基是与化合物9和10相互作用的关键氨基酸。当把serine-1543突变成Cav3.1上对应的alanine时(Cav3.2S1543A),这两个分子对突变通道的抑制作用均显著降低,特别是10号分子对Cav3.2S1543A抑制作用的IC50值与Cav3.1相当。同样的,当Cav3.1上的alanine突变成Cav3.2上对应的serine时(Cav3.1A1502S),化合物9和10的抑制作用显著增强。结合分子对接和分子动力学等计算辅助的方法,研究人员以实验数据为基础模拟了活性分子与Cav3.1/ Cav3.2的相互作用模式。研究结果表明10号分子在Cav3.2中部的空腔中形成一个类似“人”字形结构,C-3端甲氨基可以与serine-1543形成氢键,使其A-C环可以通过疏水作用很好地结合在Cav3.2的Domain II和III的开窗(fenestration)中。同时,C-20端的苯甲酰基可以延伸至Domain I和IV开窗入口处的疏水区域,形成稳定的疏水结合。基于此,C-16位上的乙酰氧基正好向上堵住了Ca2+通过Cav3.2从膜外进入膜内的selectivity filter。Cav3.1中由于在Domain II和III开窗中与serine-1543对应的位置是一个alanine,无法与10号分子C-3端的甲氨基形成氢键,结合力相对较弱。化合物9和10主要的结构差异在于A和B环的二面角不同,基于此9中C-3端的甲氨基与serine-1543的距离长于10中相应的距离(5.14 埃 vs 2.88 埃),减弱相互作用力,使其对Cav3.2的抑制作用和选择性都低于化合物10。值得指出的是化合物8对Cav3.2抑制作用较弱且无选择性。其与9的结构差别主要在于C-3位的甲氨基变成了二甲氨基,因此无法与serine-1543形成氢键。相似的,化合物11-16同样缺少能与serine-1543形成氢键的官能团,缺乏抑制作用和选择性。上述研究表明9(10/19)abeo-artane-型分子的构效关系与计算结果十分吻合。此外,研究人员的研究还表明化合物2、3和CVB-D像瓶塞一样地封住了通透离子的路径,这种作用方式是它们不具备TTCCs亚型选择性的主要原因(图1)。
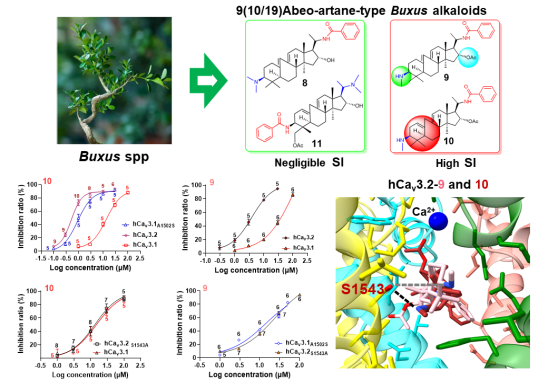
图1. BAs中9和10 对Cav3.2通道的抑制作用机制研究
在缓解疼痛作用机制研究中,发现化合物10通过直接作用于小鼠DRG神经元Cav3.2通道(不影响其表达)抑制后去极化 (ADPs)和神经元放电频率以降低神经元收到伤害刺激的兴奋性。此外,基于野生型和Cav3.2基因敲除型小鼠动物实验表明10通过选择性作用于Cav3.2显著缓解醋酸诱发的内脏痛、L-半胱氨酸诱发的躯体痛及坐骨神经结扎诱发的神经痛,且其(5 mg/kg)作用与阳性对照Z944(10 mg/kg)和mibefradil(10 mg/kg)相当(图2)。
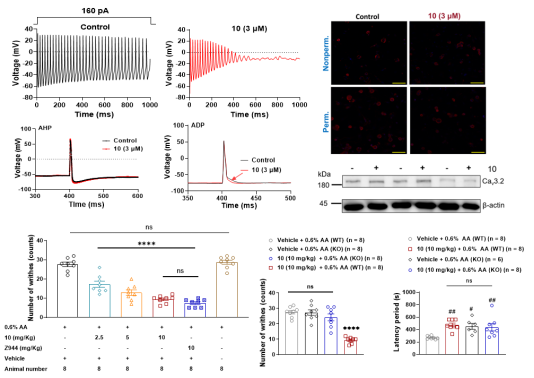
图2. 10缓解疼痛作用机制研究
综上,通过对BAs的系统研究,研究人员发现了一种结构新颖且对Cav3.2的选择性明显高于Cav3.1的镇痛化合物。阐明了这类分子与Cav3.2相互作用的结构基础,从分子层面为基于结构创新药物设计与研发夯实了基础。
近日,该研究工作以Analgesic Buxus alkaloids with Enhanced Selectivity for the Low-Voltage-Gated Calcium Channel Cav3.2 over Cav3.1 through a New Binding Mode为题作为热点论文(Hot Paper)发表在国际著名期刊《德国应用化学》(Angew. Chem. Int. Ed. https://doi.org/10.1002/anie.202313461)。中国科学院昆明植物研究所科研助理恭烨、已毕业硕士研究生刘瑞、华中科技大学硕士研究生查宏婧为该论文的共同第一作者。中国科学院昆明植物研究所年寅副研究员、华中科技大学万落生副教授为共同通讯作者。中国科学院昆明植物研究所是本工作的第一完成单位。本研究工作得到了国家自然科学基金面上项目、第二次青藏高原综合科学考察研究项目、云南省自然科学基金杰出青年专项、中国科学院“西部之光”青年学者项目等支持。