
-

生物通官微
陪你抓住生命科技
跳动的脉搏
化学学院邹鹏团队开发定量蛋白质组学方法prox-SILAC揭示亚细胞区域内蛋白质动态变化
【字体: 大 中 小 】 时间:2023年11月30日 来源:北京大学新闻网
编辑推荐:
该研究结合过氧化物酶(APEX2/HRP)介导的邻近标记技术与pulse-SILAC定量蛋白质组学方法,开发了prox-SILAC技术,通过APEX2/HRP实现标记过程的空间特异性,凭借pulse-SILAC标记定义蛋白质代谢速率的时间尺度。利用prox-SLIAC技术,实现对线粒体基质和内质网腔内蛋白质动态变化的精确鉴定,并揭示了内质网应激状态以及细胞分化过程...

真核细胞具有纷繁复杂的三维空间结构。作为生命活动的主要执行者,蛋白质在多个亚细胞空间内合成、穿梭、代谢,并在特定的区域内发挥生物学功能。解析蛋白质的局部代谢和转运规律,以及其在不同生理状态下的变化,对我们深刻理解生命过程的分子机制具有重要意义。尽管目前已有一些在全细胞水平表征蛋白质代谢速率的方法,如生物正交非天然氨基酸标记(BioOrthogonal Non-Canonical Amino acid Tagging,BONCAT)及稳定同位素标记技术(pulse-SILAC),但这些技术往往缺乏亚细胞水平上空间分辨率,难以深度揭示亚细胞区域内蛋白质组的动态变化规律。近年来,以生物素连接酶(BioID/TurboID)和过氧化物酶(APEX2/HRP)为代表的邻近标记技术在空间蛋白质组学领域得到了快速的发展,表现出优异的时空特异性和灵敏度。然而上述技术只能局限于亚细胞区域内蛋白质的丰度表征,而无法深层次的揭示蛋白质动态的代谢规律。
近日,北大-清华生命科学联合中心、北京大学化学与分子工程学院邹鹏研究员课题组在Nature Communications上发表了题为“Spatially resolved mapping of proteometurnover dynamics with subcellularprecision”的研究。该研究结合过氧化物酶(APEX2/HRP)介导的邻近标记技术与pulse-SILAC定量蛋白质组学方法,开发了prox-SILAC技术,通过APEX2/HRP实现标记过程的空间特异性,凭借pulse-SILAC标记定义蛋白质代谢速率的时间尺度。课题组利用prox-SLIAC技术,实现对线粒体基质和内质网腔内蛋白质动态变化的精确鉴定,并揭示了内质网应激状态以及细胞分化过程中内质网腔内蛋白质代谢水平的差异变化。该技术的开发为亚细胞层面上蛋白质动态变化表征提供了有力工具。

论文截图
该研究首先在HEK293T细胞线粒体基质中验证prox-SILAC方法的可行性(图1)。APEX2通过与细胞色素C氧化酶COX4的N端前导肽融合实现其在线粒体基质的表达。研究者首先利用重标SILAC培养基(Lys6,Arg8)对细胞进行4小时、8小时和12小时时间尺度的pulse-SILAC标记。随后在一分钟过氧化氢处理下,APEX2催化空间邻近的蛋白质与标记探针生物素-苯酚(biotin-phenol,BP)的共价偶联,实现生物素标记。富集后的生物素化蛋白质进一步通过LC-MS/MS予以鉴定和定量。研究者在这3个时间节点共鉴定并定量到183个蛋白质,其中162个(85%)此前存在线粒体定位注释(图1)。根据SILAC定量结果,研究者定义并计算了各蛋白质在一定时间内的代谢替换率(metabolic replacement fraction,MRF),用以衡量新合成蛋白质占蛋白质总量的比例。实验结果表明,不同生物学重复所测量得到的MRF值具有很好的相关性,表明了分析方法的稳定性和结果的可重复性。prox-SILAC标记揭示了线粒体基质蛋白质组整体代谢率的分布差异,特别是线粒体内膜上氧化呼吸链复合物及线粒体核糖体各亚基的动态变化,由此发现氧化呼吸链复合物I较其他复合物整体上具有更高的MRF值。与全细胞中pulse-SILAC方法相比,prox-SILAC同样揭示了一些氧化呼吸链亚基在线粒体中具有较全细胞中更高的MRF值。

图1. prox-SILAC标记方法在线粒体基质中的应用
研究者进一步利用prox-SILAC方法鉴定了内质网腔内蛋白质的动态变化,内质网腔内蛋白质的邻近标记由辣根过氧化物酶HRP所介导(图2)。在4小时、8小时、12小时的时间节点下,该研究同时鉴定到186个蛋白质,其中97%的蛋白质都存在分泌通路定位,ER驻留蛋白较后分泌通路蛋白整体具有更低的MRF值。与全细胞pulse-SILAC实验结果相比较,后分泌蛋白质同样在内质网腔内具有更高的新合成比例。研究者进一步对细胞表面膜蛋白质的代谢情况进行了测量,对比发现蛋白质的代谢水平与所处的亚细胞定位密切相关。如膜表面受体蛋白和离子泵蛋白TFRC、ATP1A1、IGF2R在内质网腔中具有显著更高的MRF值;而分子伴侣SERPINH1和PDIA6在内质网腔中的MRF值远小于其在细胞表面。由此可以看出,蛋白质在不同亚细胞区域内具有迥异的MRF值。这一方面反映了蛋白质合成后转运的时间轨迹,另一方面也可能涉及蛋白质存在多重定位和多重功能。
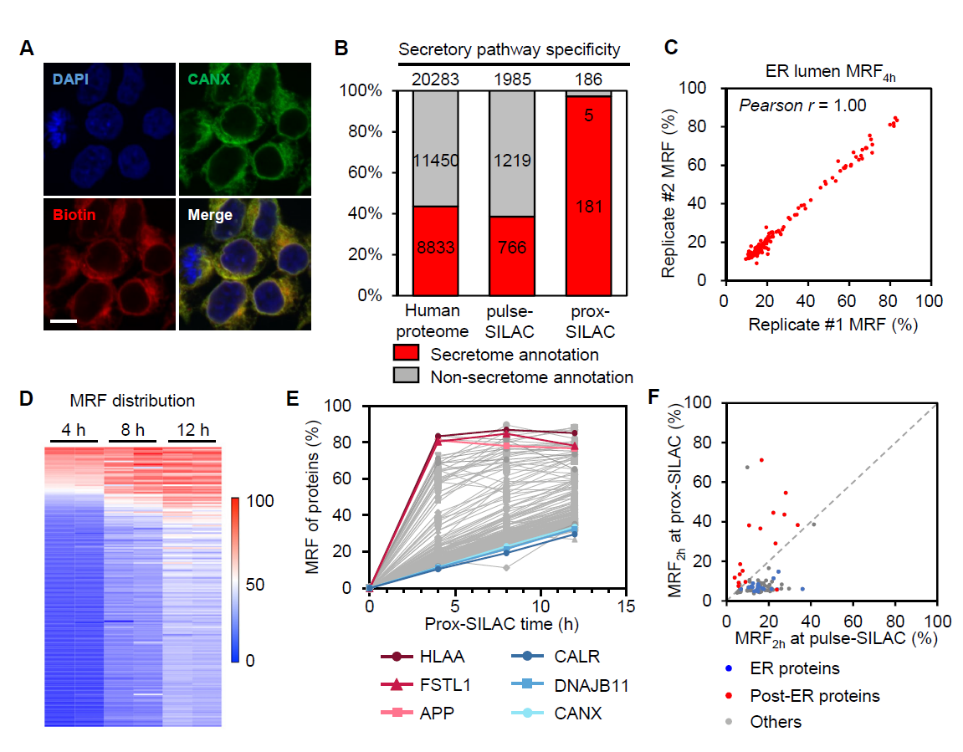
图2. prox-SILAC技术揭示内质网腔内蛋白质动态变化
相比于生理状态下,在病理状态或外界刺激干扰条件下对蛋白质稳态变化的研究对理解疾病或药物作用机理具有更重要的意义。研究者分别考察了毒胡萝卜素刺激诱发内质网应激和细胞分化过程中的内质网腔内的蛋白质代谢速率的变化。在内质网应激条件下,内质网腔内蛋白质代谢速率整体放缓,而该趋势无法通过全细胞pulse-SILAC实验所鉴定。此外本研究还鉴定到HSPA5、HSPA6、JAGN1和LMAN1等蛋白在,在毒胡萝卜素作用下代谢速率显著上调。而在反式维甲酸和脑源神经营养因子所诱导的SH-SY5Y细胞分化模型中,研究者分别在分化第0天、第7天和第10天进行prox-SILAC实验,考察内质网腔内蛋白质动态变化。研究者发现大部分内质网腔蛋白质在分化早期(第0天至第7天)代谢水平整体上调,而在分化后期(第7天至第10天)逐渐减缓。同样地,该变化趋势仍无法通过pulse-SILAC体现,凸显了亚细胞层面表征蛋白质动态变化的意义。
综上,该研究整合APEX标记技术与pulse-SILAC技术,开发了prox-SILAC方法,成功鉴定了线粒体和内质网腔内的蛋白质组动态变化,揭示了蛋白质具有亚细胞区域特异的代谢速率,为深刻解读蛋白质稳态与转运过程提供了重要化学生物学工具。值得注意的是,prox-SILAC标记在一定程度上受限于APEX2酶活性与标记偏好性,因此所鉴定到的蛋白质种类和定量结果可能存在一定偏差。
邹鹏为本论文的通讯作者,已毕业博士研究生袁锋和李逸为本论文共同第一作者。该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心、生物有机与分子工程教育部重点实验室、北京脑科学与类脑研究所的支持。
 闂備浇顕х€涒晠顢欓弽顓炵獥婵°倐鍋撻悡銈夋煟閺冨偆鍎犻柍褜鍓欓崐鍧椼€侀弴銏犖ч柛鈩冦仦缁囨⒑鐠囪尙绠抽柛瀣█瀹曟垿骞囬悧鍫濅画閻熸粎澧楃敮妤呭吹閸屾粎纾奸柛娆忣槹鐏忥箓鏌熼搹顐g缂佸倹甯為埀顒婄秵閸嬪嫬鈻撹箛鎾斀妞ゆ梻鐓鍕殾妞ゆ帊妞掔换鍡涙煢濡尨绱氶柡鍐ㄧ墛閸庡瞼绱掔€n偒鍎ユ繛宸幗缁绘繈濮€閿濆孩缍堥柣銏╁灣閸嬬喎危閹版澘绠抽柟鍐茬-閸犳牠鐛幇顓熷劅闁挎繂妫崥鍥ㄧ節閻㈤潧浠滄い鏇ㄥ幗閸掑﹦鈧潧鎽滅粈濠囨煃瑜滈崜鐔奉潖婵犳艾绀冩い鎾跺枔閵嗗﹦绱撴担浠嬪摵閻㈩垪鈧磭鏆﹂柣鏃傗拡閺佸啯銇勯幇鈺佺仼闂婏箓姊婚崒娆愮グ婵℃ぜ鍔戦幊妤呭礈娴g懓搴婂┑鐘绘涧閻楀繒绮堟繝鍥ㄥ€甸柨婵嗛婢ь垶鏌涢悩鍙夘棦闁哄被鍔岄埞鎴﹀幢濡儤顏犻梻浣告惈椤戝倿宕戦幘缁樷拻濞达絽鎲¢幆鍫ユ煕婵犱胶鐭欓柨婵堝仦瀵板嫰骞囬埞鎯т壕濞撴埃鍋撻柡浣规崌閺佹捇鏁撻敓锟�>>
闂備浇顕х€涒晠顢欓弽顓炵獥婵°倐鍋撻悡銈夋煟閺冨偆鍎犻柍褜鍓欓崐鍧椼€侀弴銏犖ч柛鈩冦仦缁囨⒑鐠囪尙绠抽柛瀣█瀹曟垿骞囬悧鍫濅画閻熸粎澧楃敮妤呭吹閸屾粎纾奸柛娆忣槹鐏忥箓鏌熼搹顐g缂佸倹甯為埀顒婄秵閸嬪嫬鈻撹箛鎾斀妞ゆ梻鐓鍕殾妞ゆ帊妞掔换鍡涙煢濡尨绱氶柡鍐ㄧ墛閸庡瞼绱掔€n偒鍎ユ繛宸幗缁绘繈濮€閿濆孩缍堥柣銏╁灣閸嬬喎危閹版澘绠抽柟鍐茬-閸犳牠鐛幇顓熷劅闁挎繂妫崥鍥ㄧ節閻㈤潧浠滄い鏇ㄥ幗閸掑﹦鈧潧鎽滅粈濠囨煃瑜滈崜鐔奉潖婵犳艾绀冩い鎾跺枔閵嗗﹦绱撴担浠嬪摵閻㈩垪鈧磭鏆﹂柣鏃傗拡閺佸啯銇勯幇鈺佺仼闂婏箓姊婚崒娆愮グ婵℃ぜ鍔戦幊妤呭礈娴g懓搴婂┑鐘绘涧閻楀繒绮堟繝鍥ㄥ€甸柨婵嗛婢ь垶鏌涢悩鍙夘棦闁哄被鍔岄埞鎴﹀幢濡儤顏犻梻浣告惈椤戝倿宕戦幘缁樷拻濞达絽鎲¢幆鍫ユ煕婵犱胶鐭欓柨婵堝仦瀵板嫰骞囬埞鎯т壕濞撴埃鍋撻柡浣规崌閺佹捇鏁撻敓锟�>>  闂傚倸鍊风欢姘缚瑜嶈灋婵°倕鎳忛崵鎰亜閺嶎偄浠滃鍛存⒑閹肩偛鍔楅柡鍛懇閹偞绻濋崶鈺佸絼闂佹悶鍎崝搴ㄥΥ閹烘鐓熼柟閭﹀墾閸旂喓绱掓潏銊ョ闁瑰嘲顑夐幖褰掝敃閵堝啫浠掗梻鍌欒兌鏋い鎴濇缁瑩骞掗弮鍌滅厯婵犮垼娉涢鍡涘磿閻斿吋鐓冮柕澶堝劚缁狙勪繆椤栨熬韬柡宀€鍠栧畷妤呭礂閻撳骸鏀俊鐐€戦崕鏌ュ箲閸ヮ兙鈧礁顫滈埀顒勭嵁閺嶃劍濯撮柣鐔碱暒閸濇姊绘担铏广€婇柛鎾寸箞瀹曟繆绠涘☉妯硷紱闂佸湱鍋撻崜姘跺触鐎n喗鐓曢柍鈺佸枤濞堟ɑ淇婇姘伃闁哄矉绲鹃幆鏃堝Ω閿斾粙鏁梻浣告啞閼归箖顢栨径鎰祦闁硅揪闄勯弲鎻掝熆鐠虹尨鍔熸い鏂挎嚇濮婃椽妫冨☉杈ㄢ枔闂佹悶鍔岀壕顓犲垝閸喎绶為柟閭﹀幘閸樹粙姊鸿ぐ鎺戜喊闁哥姵顨婂畷鐢稿焵椤掑嫭鈷戦柟鑲╁仜閳ь兙鍊濆畷鎶芥晲閸涱垱娈鹃梺璺ㄥ枔婵绮堥崘顔界厵缂備焦锚缁椻晜銇勯弬娆炬█婵﹨娅g划娆戞崉閵娧屽敹缂傚倷绀侀ˇ閬嶅礂濡櫣鏆︾憸鐗堝笒绾惧吋绻涢幋婵堬紞闁活厽顨婂铏瑰寲閺囩偛鈷夊銈冨妼閹虫劕顕ユ繝鍥ч敜婵°倓鑳堕崢浠嬫⒑闂堟稓绠為柛濠冪墪閳藉顦归柡宀嬬秮閸╁嫰宕橀鍛珰闂備浇顕栭崯顐﹀炊瑜旈崬鍫曟⒑缂佹ɑ顥堟い銉︽尰缁傛帡骞囬悧鍫㈠幗闁硅偐琛ラ崜婵堟嫻閿熺姵鐓曢悗锝庡€跨紓姘辩磼鏉堚晛浠ч柍褜鍓ㄧ紞鍡涘焵椤戞儳鐏╃紓宥咃躬瀵濡歌閸嬫捇鏁愭惔妯轰壕妞ゆ牓鍊栫€氾拷>>
闂傚倸鍊风欢姘缚瑜嶈灋婵°倕鎳忛崵鎰亜閺嶎偄浠滃鍛存⒑閹肩偛鍔楅柡鍛懇閹偞绻濋崶鈺佸絼闂佹悶鍎崝搴ㄥΥ閹烘鐓熼柟閭﹀墾閸旂喓绱掓潏銊ョ闁瑰嘲顑夐幖褰掝敃閵堝啫浠掗梻鍌欒兌鏋い鎴濇缁瑩骞掗弮鍌滅厯婵犮垼娉涢鍡涘磿閻斿吋鐓冮柕澶堝劚缁狙勪繆椤栨熬韬柡宀€鍠栧畷妤呭礂閻撳骸鏀俊鐐€戦崕鏌ュ箲閸ヮ兙鈧礁顫滈埀顒勭嵁閺嶃劍濯撮柣鐔碱暒閸濇姊绘担铏广€婇柛鎾寸箞瀹曟繆绠涘☉妯硷紱闂佸湱鍋撻崜姘跺触鐎n喗鐓曢柍鈺佸枤濞堟ɑ淇婇姘伃闁哄矉绲鹃幆鏃堝Ω閿斾粙鏁梻浣告啞閼归箖顢栨径鎰祦闁硅揪闄勯弲鎻掝熆鐠虹尨鍔熸い鏂挎嚇濮婃椽妫冨☉杈ㄢ枔闂佹悶鍔岀壕顓犲垝閸喎绶為柟閭﹀幘閸樹粙姊鸿ぐ鎺戜喊闁哥姵顨婂畷鐢稿焵椤掑嫭鈷戦柟鑲╁仜閳ь兙鍊濆畷鎶芥晲閸涱垱娈鹃梺璺ㄥ枔婵绮堥崘顔界厵缂備焦锚缁椻晜銇勯弬娆炬█婵﹨娅g划娆戞崉閵娧屽敹缂傚倷绀侀ˇ閬嶅礂濡櫣鏆︾憸鐗堝笒绾惧吋绻涢幋婵堬紞闁活厽顨婂铏瑰寲閺囩偛鈷夊銈冨妼閹虫劕顕ユ繝鍥ч敜婵°倓鑳堕崢浠嬫⒑闂堟稓绠為柛濠冪墪閳藉顦归柡宀嬬秮閸╁嫰宕橀鍛珰闂備浇顕栭崯顐﹀炊瑜旈崬鍫曟⒑缂佹ɑ顥堟い銉︽尰缁傛帡骞囬悧鍫㈠幗闁硅偐琛ラ崜婵堟嫻閿熺姵鐓曢悗锝庡€跨紓姘辩磼鏉堚晛浠ч柍褜鍓ㄧ紞鍡涘焵椤戞儳鐏╃紓宥咃躬瀵濡歌閸嬫捇鏁愭惔妯轰壕妞ゆ牓鍊栫€氾拷>>  闂傚倸鍊峰ù鍥綖婢跺⿴娓婚柛褎顨呴崒銊ノ旈敐鍛灕缂傚秵鐗楃换婵嬫濞戝崬鍓扮紒缁㈠幐閸嬫捇姊绘担鍛婃儓婵炲眰鍔嶉幈銊╂倻閼恒儱鍓归柟鍏肩暘閸斿秹鎮¢悩纰樺亾鐟欏嫭绀€婵炲眰鍊栫粋鎺楁晜閸撗咃紲婵炶揪绲介幗婊堝箺閻樼粯鐓欐い鏍ㄧ⊕椤ュ牓鏌℃担瑙勫磳闁轰焦鎹囬弫鎾绘晸閿燂拷-婵犵數濮烽弫鎼佸磿閹寸姴绶ら柦妯侯槺閺嗭附銇勯幒鎴濐仼闁活厽顨婇弻娑㈠焺閸愶紕绱板銈傛櫆閻擄繝寮诲☉銏犵労闁告劖鍎冲В鈧梻浣告贡閸庛倝骞愮紒妯碱洸闁靛牆妫涚粻楣冩煕閳╁叐鎴犱焊椤忓牊鐓冪憸婊堝礈濞嗘垹鐭撻柟缁㈠櫙缂嶆牠鏌曡箛瀣偓鏍疾閺屻儲鐓曟繛鎴濆船閺嬶箓鏌涘鐓庝喊婵﹨娅i幃浼村灳閸忓懎顥氶梻鍌欐祰瀹曠敻宕伴幇顒夌唵婵☆垵鍋愮粈濠傘€掑锝呬壕闂佸搫鐬奸崰鎾诲焵椤掍胶鈯曢柨姘舵煟韫囥儳绋荤紒缁樼箖缁绘繈宕橀妸褌娣俊鐐€栧ú鈺冪礊娓氣偓瀹曟椽鍩€椤掍降浜滈柟鐑樺灥閳ь剙鍢查埢浠嬵敂閸喓鍘搁梺鎼炲劗閺呮盯顢撶仦鍓х闁兼祴鏅涢埢鍫ユ煙椤旂瓔娈旈柍钘夘樀瀹曟ê顔忛钘夋灎闂傚倷鑳剁划顖炴偋閻愭祴鏋嶉柨婵嗘搐閸ㄦ繃鎱ㄥΟ鎸庣【缂佲偓閸緷褰掓晲閸涱喛纭€闂佸搫妫涙繛鈧慨濠冩そ閹兘骞嶉濠氬仐闂備胶枪椤戝棝骞戦崶顒€钃熼柨鐔哄Т闁卞洦銇勯幒宥囶槮妞ゅ骏鎷�>>
闂傚倸鍊峰ù鍥綖婢跺⿴娓婚柛褎顨呴崒銊ノ旈敐鍛灕缂傚秵鐗楃换婵嬫濞戝崬鍓扮紒缁㈠幐閸嬫捇姊绘担鍛婃儓婵炲眰鍔嶉幈銊╂倻閼恒儱鍓归柟鍏肩暘閸斿秹鎮¢悩纰樺亾鐟欏嫭绀€婵炲眰鍊栫粋鎺楁晜閸撗咃紲婵炶揪绲介幗婊堝箺閻樼粯鐓欐い鏍ㄧ⊕椤ュ牓鏌℃担瑙勫磳闁轰焦鎹囬弫鎾绘晸閿燂拷-婵犵數濮烽弫鎼佸磿閹寸姴绶ら柦妯侯槺閺嗭附銇勯幒鎴濐仼闁活厽顨婇弻娑㈠焺閸愶紕绱板銈傛櫆閻擄繝寮诲☉銏犵労闁告劖鍎冲В鈧梻浣告贡閸庛倝骞愮紒妯碱洸闁靛牆妫涚粻楣冩煕閳╁叐鎴犱焊椤忓牊鐓冪憸婊堝礈濞嗘垹鐭撻柟缁㈠櫙缂嶆牠鏌曡箛瀣偓鏍疾閺屻儲鐓曟繛鎴濆船閺嬶箓鏌涘鐓庝喊婵﹨娅i幃浼村灳閸忓懎顥氶梻鍌欐祰瀹曠敻宕伴幇顒夌唵婵☆垵鍋愮粈濠傘€掑锝呬壕闂佸搫鐬奸崰鎾诲焵椤掍胶鈯曢柨姘舵煟韫囥儳绋荤紒缁樼箖缁绘繈宕橀妸褌娣俊鐐€栧ú鈺冪礊娓氣偓瀹曟椽鍩€椤掍降浜滈柟鐑樺灥閳ь剙鍢查埢浠嬵敂閸喓鍘搁梺鎼炲劗閺呮盯顢撶仦鍓х闁兼祴鏅涢埢鍫ユ煙椤旂瓔娈旈柍钘夘樀瀹曟ê顔忛钘夋灎闂傚倷鑳剁划顖炴偋閻愭祴鏋嶉柨婵嗘搐閸ㄦ繃鎱ㄥΟ鎸庣【缂佲偓閸緷褰掓晲閸涱喛纭€闂佸搫妫涙繛鈧慨濠冩そ閹兘骞嶉濠氬仐闂備胶枪椤戝棝骞戦崶顒€钃熼柨鐔哄Т闁卞洦銇勯幒宥囶槮妞ゅ骏鎷�>>  濠电姷鏁搁崑鐐哄垂閸洖绠板┑鐘崇閸嬪绻濇繝鍌滃闁汇倗鍋撻妵鍕箛閸洘顎嶆繝娈垮灠閸氬绌辨繝鍥ч柛灞剧煯婢规洟姊绘担绛嬪殐闁哥姵顨呭嵄闁哄嫮鐏價mo Fisher闂傚倷娴囧畷鍨叏瀹ュ绀嬫い鎾跺枎閸ㄨ京绱撻崒娆戣窗闁革綆鍣e畷褰掓焼瀹撱儱娲︾€佃偐鈧稒锚閳ь剛鍏橀弻鐔封枔閸喗鐏撻梺纭呮珪閸旀瑩寮婚敐鍫㈢杸闁规儳澧庨澶娾攽椤旂》宸ユい顓犲厴閺佹劙鎮欓崫鍕敤濡炪倖鎸鹃崑鐔碱敊閸涘瓨鈷戦梺顐ゅ仜閼活垱鏅剁€涙﹩娈介柣鎰皺缁犱即鏌嶉挊澶樻Ц妤楊亙鍗抽崺鈧い鎺戝€搁崹婵囥亜椤忓嫷鍚檈ld Application Scientist闂傚倸鍊风欢姘缚瑜嶈灋闁哄啠鍋撻柟顖涙煥閵嗘帗绋婄花涔猼ing Develop缂傚倸鍊搁崐鐑芥倿閿斿墽鐭欓柟娆¤娲幖褰掝敃閵堝孩閿ら梺璇插缁嬫帟鎽繝娈垮灠椤曨參鍩€椤掆偓缁犲秹宕曟潏鈺傚床闁圭儤姊婚惌鍡楊熆閼搁潧濮堥柛瀣剁秮閺屾盯濡疯閸樺瓨淇婄紒銏犳珝闁哄本绋掗幆鏃堟晬閸曨収鍞洪梻浣哥秺椤ユ挻绻涢埀顒勬煛鐏炶濡块柍褜鍓ㄧ紞鍡涘礈濞嗗浚鍤曢柕濞炬櫆閳锋垶绻涢懠棰濆敽缂併劎绮妵鍕箣濠靛洤鏋犻悗娈垮櫘閸嬪﹪鐛Ο鑲╃<婵☆垵妗ㄧ純鏇㈡⒒娴gǹ鏆遍柟纰卞亰楠炲﹥寰勯幇顒傦紱闂佸湱鍋撻崜姘缚閳哄倶浜滈柟鏉垮閹吋绻濊鐎氭澘顫忔ウ瑁や汗闁圭儤鎸婚柨顓犵磽娴e壊妲告い鏇ㄥ幘閸掓帡鍩¢崨顓㈠敹闂佸搫娲ㄩ崑鐐茬暤瀹ュ鈷戠紓浣姑悘锕€鐣濋敐鍛仴鐎规洜鍎ゅ鍕箛椤撶姴骞楅梻浣稿暱閹碱偊鏁冮妶鍛瀺婵炲棙鍨圭壕濂告煙閹绘帩鍎愰悗姘炬嫹>>
濠电姷鏁搁崑鐐哄垂閸洖绠板┑鐘崇閸嬪绻濇繝鍌滃闁汇倗鍋撻妵鍕箛閸洘顎嶆繝娈垮灠閸氬绌辨繝鍥ч柛灞剧煯婢规洟姊绘担绛嬪殐闁哥姵顨呭嵄闁哄嫮鐏價mo Fisher闂傚倷娴囧畷鍨叏瀹ュ绀嬫い鎾跺枎閸ㄨ京绱撻崒娆戣窗闁革綆鍣e畷褰掓焼瀹撱儱娲︾€佃偐鈧稒锚閳ь剛鍏橀弻鐔封枔閸喗鐏撻梺纭呮珪閸旀瑩寮婚敐鍫㈢杸闁规儳澧庨澶娾攽椤旂》宸ユい顓犲厴閺佹劙鎮欓崫鍕敤濡炪倖鎸鹃崑鐔碱敊閸涘瓨鈷戦梺顐ゅ仜閼活垱鏅剁€涙﹩娈介柣鎰皺缁犱即鏌嶉挊澶樻Ц妤楊亙鍗抽崺鈧い鎺戝€搁崹婵囥亜椤忓嫷鍚檈ld Application Scientist闂傚倸鍊风欢姘缚瑜嶈灋闁哄啠鍋撻柟顖涙煥閵嗘帗绋婄花涔猼ing Develop缂傚倸鍊搁崐鐑芥倿閿斿墽鐭欓柟娆¤娲幖褰掝敃閵堝孩閿ら梺璇插缁嬫帟鎽繝娈垮灠椤曨參鍩€椤掆偓缁犲秹宕曟潏鈺傚床闁圭儤姊婚惌鍡楊熆閼搁潧濮堥柛瀣剁秮閺屾盯濡疯閸樺瓨淇婄紒銏犳珝闁哄本绋掗幆鏃堟晬閸曨収鍞洪梻浣哥秺椤ユ挻绻涢埀顒勬煛鐏炶濡块柍褜鍓ㄧ紞鍡涘礈濞嗗浚鍤曢柕濞炬櫆閳锋垶绻涢懠棰濆敽缂併劎绮妵鍕箣濠靛洤鏋犻悗娈垮櫘閸嬪﹪鐛Ο鑲╃<婵☆垵妗ㄧ純鏇㈡⒒娴gǹ鏆遍柟纰卞亰楠炲﹥寰勯幇顒傦紱闂佸湱鍋撻崜姘缚閳哄倶浜滈柟鏉垮閹吋绻濊鐎氭澘顫忔ウ瑁や汗闁圭儤鎸婚柨顓犵磽娴e壊妲告い鏇ㄥ幘閸掓帡鍩¢崨顓㈠敹闂佸搫娲ㄩ崑鐐茬暤瀹ュ鈷戠紓浣姑悘锕€鐣濋敐鍛仴鐎规洜鍎ゅ鍕箛椤撶姴骞楅梻浣稿暱閹碱偊鏁冮妶鍛瀺婵炲棙鍨圭壕濂告煙閹绘帩鍎愰悗姘炬嫹>>  闂傚倸鍊风粈渚€骞夐敓鐘茬鐟滅増甯掔粈鍫熺節闂堟侗鍎涢柡浣割儔閺屽秹宕崟顐熷亾鐟欏嫮顩查柕鍫濐槹閻撴洟鏌曟径瀣仴閻庢凹鍓氱粋宥夋焼瀹ュ棌鎷洪梺鍦瑰ù鐑藉Υ閹烘鐓曢柣妯挎珪缁€鍫㈢磼椤旇姤鈷掗柍褜鍓氱粙鎺曟懌婵炲瓨鍤庨崐婵嬪蓟閵娾晜鍋嗛柛灞剧☉椤忥拷14濠电姷鏁告慨浼村垂瑜版帗鍊堕柛顐犲劚閻ょ偓绻涢幋娆忕仾闁稿浜弻娑㈠即閵娿儱鈷掑┑鐐茬墢閺咁偊鍩€椤掆偓閸樻粓宕戦幘缁樼厓鐟滄粓宕滈悢鐓庣畺濞村吋娼欏敮闂佸疇妗ㄩ懗鍫曟偂閹达附鈷戦柟绋挎捣缁犳挻绻涚拠褏鐣甸柟顕€绠栭弻鍡楊吋閸℃瑥骞橀梻浣告啞閻熴儵藝鏉堚晝涓嶆慨妯垮煐閻撴洟鏌熼悙顒佺稇妞ゃ儱顑囩槐鎺撴綇閵娿儲璇為悗瑙勬礀瀹曨剟锝炲┑瀣垫晢闁逞屽墯閹便劑宕橀瑙f嫼闂佸湱枪妤犳悂宕伴弴銏$厵闁告垯鍊栫€氾拷>>
闂傚倸鍊风粈渚€骞夐敓鐘茬鐟滅増甯掔粈鍫熺節闂堟侗鍎涢柡浣割儔閺屽秹宕崟顐熷亾鐟欏嫮顩查柕鍫濐槹閻撴洟鏌曟径瀣仴閻庢凹鍓氱粋宥夋焼瀹ュ棌鎷洪梺鍦瑰ù鐑藉Υ閹烘鐓曢柣妯挎珪缁€鍫㈢磼椤旇姤鈷掗柍褜鍓氱粙鎺曟懌婵炲瓨鍤庨崐婵嬪蓟閵娾晜鍋嗛柛灞剧☉椤忥拷14濠电姷鏁告慨浼村垂瑜版帗鍊堕柛顐犲劚閻ょ偓绻涢幋娆忕仾闁稿浜弻娑㈠即閵娿儱鈷掑┑鐐茬墢閺咁偊鍩€椤掆偓閸樻粓宕戦幘缁樼厓鐟滄粓宕滈悢鐓庣畺濞村吋娼欏敮闂佸疇妗ㄩ懗鍫曟偂閹达附鈷戦柟绋挎捣缁犳挻绻涚拠褏鐣甸柟顕€绠栭弻鍡楊吋閸℃瑥骞橀梻浣告啞閻熴儵藝鏉堚晝涓嶆慨妯垮煐閻撴洟鏌熼悙顒佺稇妞ゃ儱顑囩槐鎺撴綇閵娿儲璇為悗瑙勬礀瀹曨剟锝炲┑瀣垫晢闁逞屽墯閹便劑宕橀瑙f嫼闂佸湱枪妤犳悂宕伴弴銏$厵闁告垯鍊栫€氾拷>>  生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
