
-

生物通官微
陪你抓住生命科技
跳动的脉搏
王波团队揭示ULK1/2-PXN机械转导通路抑制乳腺癌细胞迁移的新机制
【字体: 大 中 小 】 时间:2023年10月31日 来源:厦门大学生命科学学院
编辑推荐:
2023年10月17日,王波教授和圣裘德儿童研究医院Mondira Kundu教授团队在EMBO Reports上发表了题为“An ULK1/2-PXN mechanotransduction pathway suppresses breast cancer cell migration”的研究成果

乳腺癌是女性中最常见的恶性肿瘤之一,其发生发展受到细胞外基质(ECM)的调节。ECM是一种复杂的多聚物网络,包含多种结构和功能蛋白。ECM不仅提供了细胞生长和分化所需的物理支架和化学信号,还通过改变其生化组成或力学特性来影响细胞行为。ECM与细胞之间的信息交流主要通过粘附斑(FAs)来实现,FAs是一种动态的蛋白质组装体,负责机械信号的感知和转导。当ECM与跨膜异二聚体整合素受体结合时,FAs内部会招募众多蛋白组分,并与肌动蛋白骨架相连。随着ECM刚度的增加,细胞通过肌动蛋白聚合和肌动蛋白马达主动增强对抗性的收缩和张力。将机械信号转化为生化信号,调节细胞行为。
乳腺癌相关组织表现出比正常乳腺组织更高的刚度。目前已经广泛认识到,高硬度的ECM促进乳腺癌细胞的侵袭。然而,ECM机械特性的变化如何转化为指导细胞迁移和转移的生化信号仍然知之甚少。

2023年10月17日,王波教授和圣裘德儿童研究医院Mondira Kundu教授团队在EMBO Reports上发表了题为“An ULK1/2-PXN mechanotransduction pathway suppresses breast cancer cell migration”的研究成果。该研究表明自噬诱导激酶ULK1以不依赖自噬的方式磷酸化PXN/Paxillin S32和S119位点,从而破坏Paxillin相分离能力并阻碍黏着斑的组装,最终抑制细胞的黏附和迁移。本文揭示了ULK1/2作为PXN的重要调节因子在机械转导中的新功能,也为乳腺癌的诊断和治疗提供了新的靶点。
为了探索 ECM、机械传导和自噬之间的关系,作者首先分析了乳腺癌患者组织和正常组织的蛋白质表达,发现肿瘤样本中某些 ECM 蛋白(包括胶原蛋白和纤连蛋白)、细胞收缩和整合素信号传导的几种标志物水平升高,而自噬活性的几个关键蛋白中只有ULK1显著下调。随后利用单细胞RNA测序数据,作者比较了正常和恶性乳腺上皮细胞的基因表达,发现与FA和细胞皮层相关的基因显著上调。为了检测乳腺癌细胞中ULK1水平降低与机械转导途径的异常激活是否相关,作者分别构建了回补空载(EV)、ULK1野生型(WT )、ULK1激酶失活型 (KD) 的MDA-MB-231和Hela细胞系,并通过Transwell实验证明ULK1 WT(而非ULK1 KD)能显著阻碍细胞迁移。与之相对应的,作者同样检测到该组细胞铺展的延迟、FA的组装、整合素下游信号的抑制、牵引力显微镜(TFM)检测的细胞收缩力减弱以及原子力显微镜 (AFM) 测量的细胞硬度降低等现象,这些结果共同证明了ULK1作为细胞迁移和收缩的负调控因子,阻碍肌动蛋白的组装和机械力的转导。
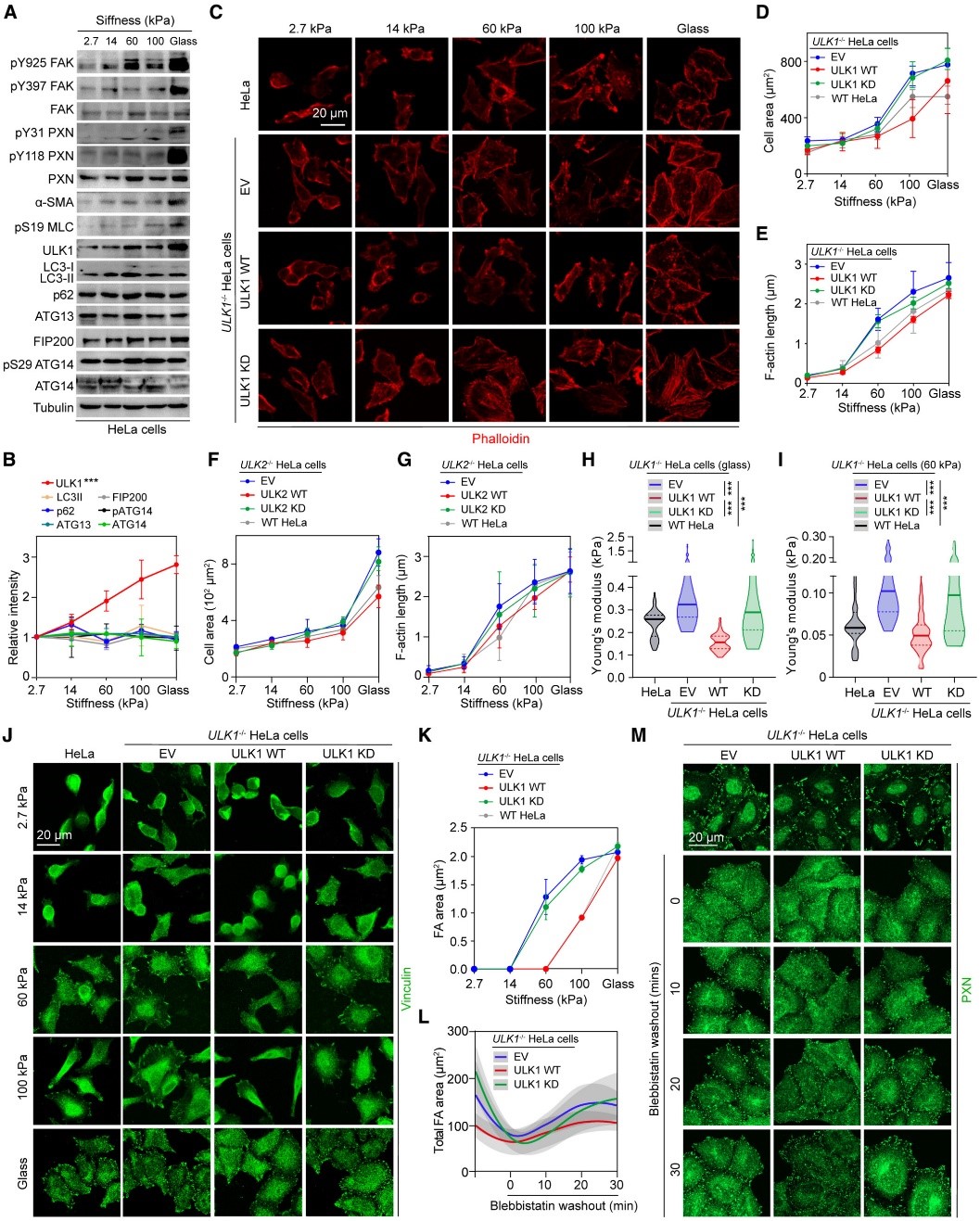
图1 ULK1/2抑制细胞铺展与FA的组装
为了探究 ULK1/2 发挥这些功能的分子机制,作者将目光聚焦到PXN,一种被充分研究的FA接头蛋白,在果蝇中已被证明与ULK1/2存在遗传相互作用。作者也在HEK293T细胞中通过免疫沉淀实验检测到ULK1和PXN存在相互作用,同时在Hela细胞中能够观察到它们存在很好的共定位。考虑到与 ULK1/2 相互作用的蛋白质通常是这些激酶的直接底物,作者通过体外激酶实验证明了ULK1能够在S32和S119位点直接磷酸化PXN。ULK1介导的PXN磷酸化的具体功能是什么?作者发现回补PXN WT,尤其是回补磷酸化缺陷型 2SA,可以显著恢复PXN敲除对细胞迁移和机械力转导造成的影响,而回补磷酸化模拟型2SD组则几乎不能做到。综上所述,这些结果表明 ULK1/2 对 PXN 的磷酸化能抑制细胞力学,而细胞力学的功能障碍会促进乳腺癌转移。
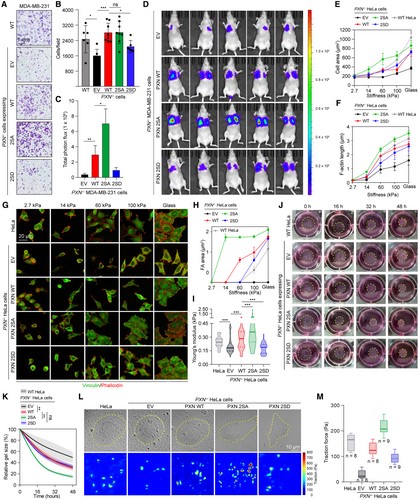
图2 ULK1/2对PXN的磷酸化阻碍乳腺癌细胞机械力的转导
鉴于作者未发表的数据,表明PXN通过液-液相分离(LLPS)促进胞质FA复合物的大分子组装,作者假设ULK1介导的PXN磷酸化可能会影响PXN LLPS。所以作者利用体外/体内蛋白相分离、光漂白后荧光恢复 (FRAP)和双磺基琥珀酰亚胺基辛二酸酯 (BS3)交联等实验,证明了该磷酸化通过削弱PXN同型相互作用,减慢分子热力学,因此增加 其LLPS 的阈值,从而导致 FA 组装/成熟受阻。
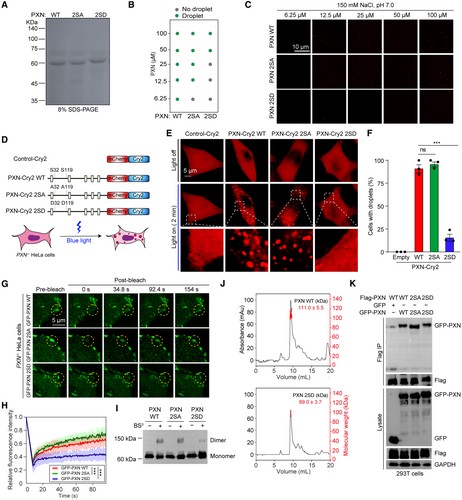
图3 ULK1/2对PXN的磷酸化减弱其相分离能力
随后的研究还表明,丝氨酸激酶ULK1/2和酪氨酸激酶FAK/Src通过竞争性磷酸化在力传导中发挥拮抗作用。在体外和细胞中,一种激酶(ULK1/2或FAK/Src)对显着减弱了另一种激酶(FAK/Src或ULK1/2)对 PXN 的磷酸化。作者认为两类激酶的这种精细的调节机制可能反映了细胞中控制机械传感与转导的复杂程序。
本研究详细描述了自噬诱导丝氨酸/苏氨酸激酶ULK1和ULK2在机械转导中的新作用。作者发现ULK1/2活性抑制肌动蛋白应力纤维和粘着斑(FA)的组装,从而阻碍细胞收缩和迁移,与其在自噬中的作用无关。从机制上讲,作者将PXN/paxillin(力传导机制的关键组成部分)确定为ULK1/2的直接结合分子和底物。ULK1/2介导的PXN在S32和S119处的磷酸化削弱了PXN的同型相互作用和液-液相分离,损害FA组装,进而改变乳腺癌细胞的机械特性及其对机械刺激的反应。ULK1/2和被充分研究的PXN调节因子FAK/Src在机械转导方面具有相反的功能,并竞争相邻丝氨酸和酪氨酸残基的磷酸化。综上所述,作者的研究表明ULK1/2是PXN依赖性机械转导的重要调节因子,并且首次证明了翻译后修饰与 LLPS、FA动力学、机械转导和肿瘤转移之间的因果关系,为调节FA(膜相关缩合物)的材料特性来治疗乳腺癌提供新的视角。
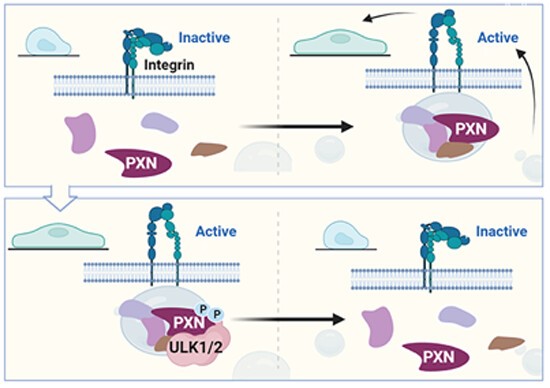
图4 ULK1/2磷酸化PXN抑制细胞机械转导信号的激活
王波教授和圣裘德儿童研究医院Mondira Kundu教授为该论文的共同通讯作者,厦门大学细胞应激国家重点实验室博士后梁沛钢,在读博士生张佳琪,已毕业硕士生吴宇晨和在读硕士生郑善元为论文的共同第一作者。该研究得到国家自然科学基金项目等的资助。
全文链接:https://www.embopress.org/doi/full/10.15252/embr.202356850
(图/文 王波课题组)
 生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
