
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Communications | 盘状结构域受体1(DDR1)是内皮细胞中新的力学感受器
【字体: 大 中 小 】 时间:2023年10月17日 来源:北京大学基础医学院
编辑推荐:
2023年10月13日,北京大学医学部基础医学院生理学与病理生理学系周菁课题组与中科院生物物理研究所李伟课题组合作在Nature Communications 杂志在线发表了题为Endothelial Discoidin Domain Receptor 1 Senses Flow to Modulate YAP Activation的研究论文

2023年10月13日,北京大学医学部基础医学院生理学与病理生理学系周菁课题组与中科院生物物理研究所李伟课题组合作在Nature Communications杂志在线发表了题为Endothelial Discoidin Domain Receptor 1 Senses Flow to Modulate YAP Activation的研究论文。该研究首次发现并证明了盘状结构域受体DDR1可以充当内皮细胞中直接的力学感受器,并通过单分子磁镊技术解析了DDR1在力学刺激后发生构象改变的关键结构域。

血流剪切力在血管生成、血管稳态和动脉粥样硬化疾病中发挥着关键作用。力学感受器作为细胞外力学信号的“第一响应者”,负责将力学信号转化为细胞内的生物化学信号,从而影响一系列的细胞行为。因此,探索并发现新的力学感受器以及解析其力学感知的结构基础对治疗心血管疾病具有重要意义。
该课题组的前期研究发现,酪氨酸激酶受体家族成员——盘状结构域受体1(DDR1)可以充当平滑肌细胞中的基质刚度感受器(Bioactive Materials 2022),并可以在生化和机械信号的刺激下发生“液-液相分离”(LLPS)这种细胞内很多重要生命过程——包括无膜细胞器的形成等——的关键过程,从而调控下游信号通路(Circulation Research 2023)。然而,DDR1能否介导内皮细胞对血流剪切力的响应尚不清楚。在此项研究中,研究者通过平行板流动腔和微流控模型在体外模拟层流和扰流,证明了DDR1参与了内皮细胞对血流剪切力的功能响应。此外,研究者还构建了内皮特异性Ddr1敲除小鼠,对其进行了左颈动脉部分结扎,3天后通过尾静脉注射AAV8-PCSK9病毒,并给予高胆固醇饮食以诱导动脉粥样硬化。结果显示,Ddr1敲除显著抑制了血管内膜炎性粘附分子的表达和动脉粥样硬化斑块形成。
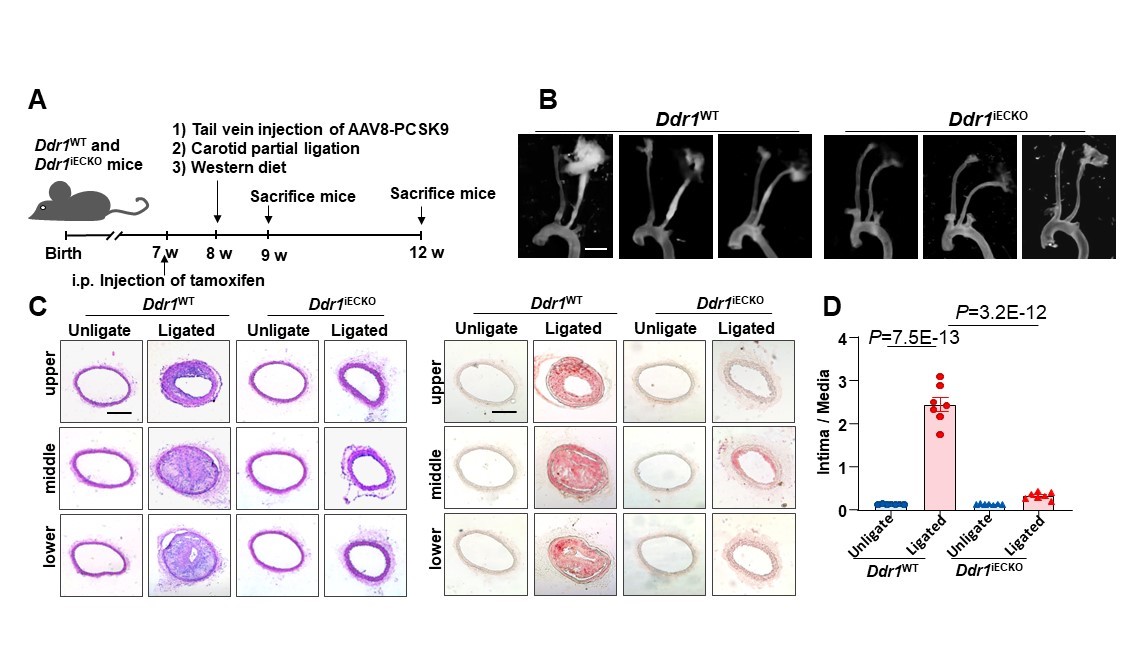
图1. Ddr1内皮特异性敲除缓解扰流加速的动脉粥样硬化
为了证明DDR1能直接感受力学刺激,研究者通过包被DDR1配体或者抗体的磁珠对内皮细胞表面的DDR1蛋白特异性地施加皮牛级的拉力,然后观察DDR1能否被激活。结果显示,在包被胶原蛋白或者DDR1抗体的磁珠的牵拉下,可在磁珠周围观察到明显的DDR1凝聚体形成。接下来,为了解析DDR1力学感知的关键结构域,研究者通过单分子磁镊技术对DDR1胞外域蛋白的解折叠动力学进行了解析。结果显示,DDR1胞外的DS-like结构域的开放构象对DDR1的力学响应十分重要。
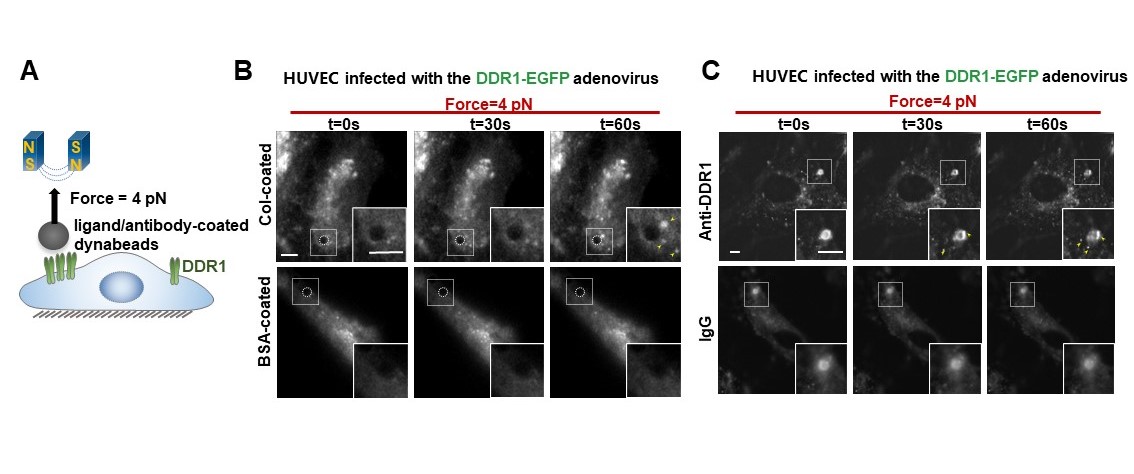
图2. DDR1可以直接感受力学刺激
最后,研究者通过免疫共沉淀联合质谱技术,探究了DDR1会与哪些下游蛋白相互作用,并筛选出64种在OS/PS条件下与DDR1结合显著变化的蛋白质。通过蛋白相互作用网络分析,研究者关注到了位于此网络核心的YWHAE(14-3-3ε)蛋白。值得一提的是,14-3-3蛋白家族已被报道可以调控其结合伴侣的液-液相分离,且14-3-3ε可以与胞浆中磷酸化的YAP结合并导致其降解。通过体外相分离、荧光漂白恢复和活细胞成像、Co-IP和免疫荧光等技术,此研究进一步证明了活化的DDR1可以通过与14-3-3ε共同相分离,从而隔离了14-3-3ε,促进了YAP的稳定性和入核,进而促进了动脉粥样硬化的发生发展。
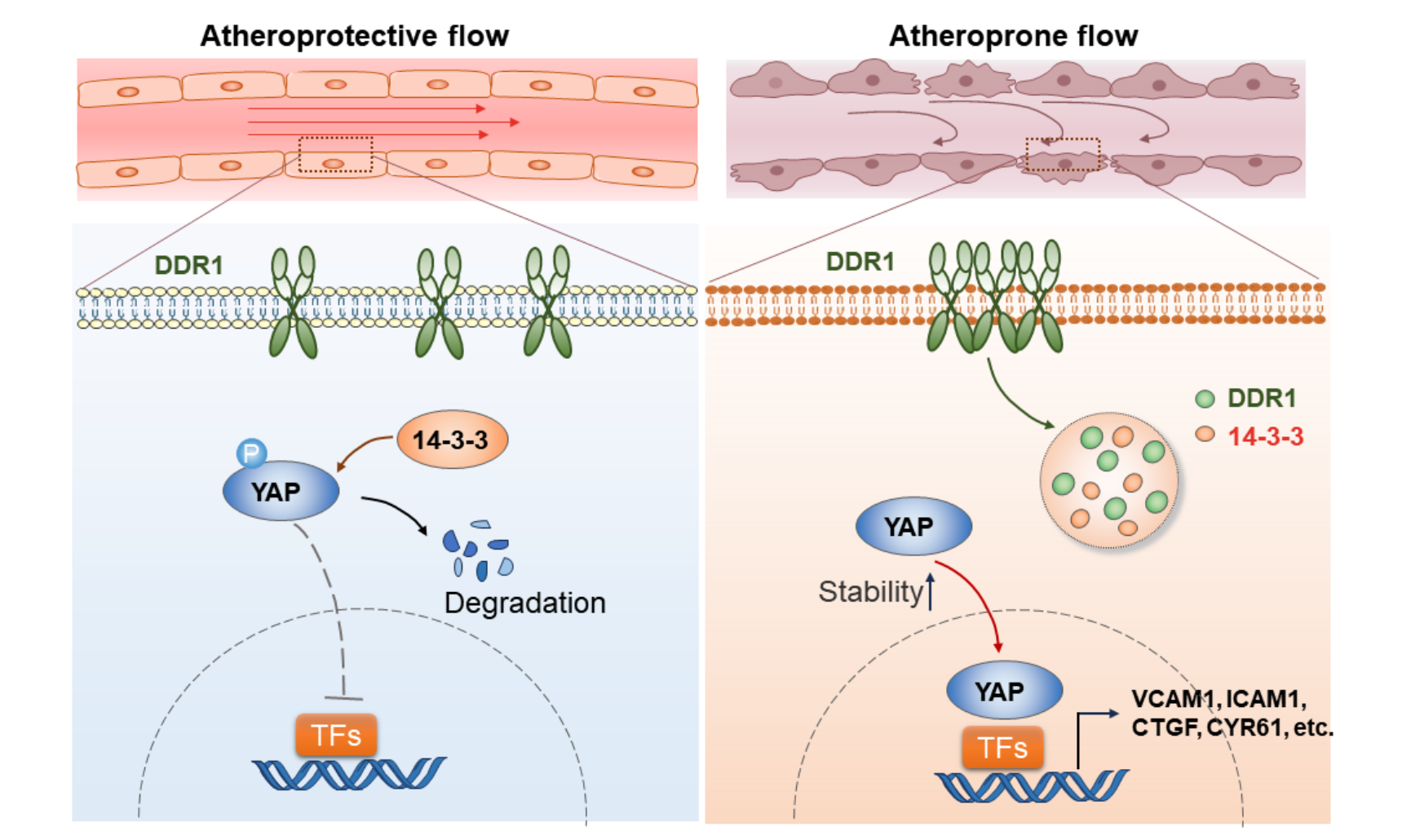
图3. DDR1感知不同模式的流体剪切力,以受体相分离启动机械信号转导,调控YAP活化
北京大学基础医学院生理学与病理生理学系博士生刘佳钰和博士后赵川榕为该论文的共同第一作者,北京大学生理学与病理生理学系周菁研究员和中科院生物物理研究所李伟研究员为共同通讯作者。该工作还得到了大连理工大学刘波教授和北京大学生理学与病理生理学系张炜真教授的帮助,并得到北京大学医学部医药卫生分析中心共聚焦成像平台和天然药物及仿生药物国家重点实验室质谱平台的技术支持。该研究受到国家自然科学基金和中国科学院战略性先导科技专项的资助。
原文链接:https://www.nature.com/articles/s41467-023-42341-z
 缂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏃傛櫕娴犳碍绻濆▓鍨灍閼垦囨煕閺傚潡鍙勯柛鈹惧亾濡炪倖甯婄粈渚€宕伴弴鐘电<闁绘ê鍟块悘鎾煙椤斿搫鍔﹂柡浣规崌閺佹捇鏁撻敓锟� | 闂傚倸鍊峰ù鍥ㄧ珶閸澀鐒婃繛鍡樺姈閸欏繘鏌熼鍡楄嫰濞堛劍绻濋悽闈浶i柤褰掔畺瀹曪絾绻濋崶褏顔愬┑鐑囩秵閸撴瑩鎮橀鍡樺仏婵犻潧顑嗛埛鎴︽煕濞戞﹫宸ョ紒妤佸笚娣囧﹪顢曢敐搴㈢杹闂佽鍠栭幖顐︼綖濠婂牊鍋ょ紒鈧弰绛洪梻鍌氬€烽悞锔锯偓绗涘懐鐭欓柟鐑橆殕閸ゅ苯螖閿濆懎鏋ら柡浣革躬閺屸€愁吋閸愩劌顬嬮梺宕囩帛濡啴寮婚妶鍡樺弿闁归偊鍏橀崑鎾澄旈崨顔煎壒闁瑰吋鐣崝宥夋偂閻樼鍋撶憴鍕婵炲眰鍊栫粋鎺楀煛閸涱喚鍘撻梺闈涱檧婵″洭鎯岄幒妤佺厵闁惧浚鍋呯亸浼存煙瀹勭増鍤囬柟顔界矊铻i柛蹇撳悑椤斿繘姊婚崒娆掑厡闁稿鍔戝畷鏇㈡嚑椤掆偓閸ㄦ繈鎮橀悙闈涗壕闁告瑥绻橀弻锝夊箛椤旂厧濡洪梺缁樺笒椤兘寮婚敐澶婃闁割煈鍠楅崐顖炴⒑閸濆嫭顥為柣鈺婂灦瀵顓兼径濞€劑鏌ㄩ弬鍨挃妞ゆ柨娲ㄧ槐鎾存媴閻熺増鏆伴梺鐟板殩閹凤拷>>
缂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏃傛櫕娴犳碍绻濆▓鍨灍閼垦囨煕閺傚潡鍙勯柛鈹惧亾濡炪倖甯婄粈渚€宕伴弴鐘电<闁绘ê鍟块悘鎾煙椤斿搫鍔﹂柡浣规崌閺佹捇鏁撻敓锟� | 闂傚倸鍊峰ù鍥ㄧ珶閸澀鐒婃繛鍡樺姈閸欏繘鏌熼鍡楄嫰濞堛劍绻濋悽闈浶i柤褰掔畺瀹曪絾绻濋崶褏顔愬┑鐑囩秵閸撴瑩鎮橀鍡樺仏婵犻潧顑嗛埛鎴︽煕濞戞﹫宸ョ紒妤佸笚娣囧﹪顢曢敐搴㈢杹闂佽鍠栭幖顐︼綖濠婂牊鍋ょ紒鈧弰绛洪梻鍌氬€烽悞锔锯偓绗涘懐鐭欓柟鐑橆殕閸ゅ苯螖閿濆懎鏋ら柡浣革躬閺屸€愁吋閸愩劌顬嬮梺宕囩帛濡啴寮婚妶鍡樺弿闁归偊鍏橀崑鎾澄旈崨顔煎壒闁瑰吋鐣崝宥夋偂閻樼鍋撶憴鍕婵炲眰鍊栫粋鎺楀煛閸涱喚鍘撻梺闈涱檧婵″洭鎯岄幒妤佺厵闁惧浚鍋呯亸浼存煙瀹勭増鍤囬柟顔界矊铻i柛蹇撳悑椤斿繘姊婚崒娆掑厡闁稿鍔戝畷鏇㈡嚑椤掆偓閸ㄦ繈鎮橀悙闈涗壕闁告瑥绻橀弻锝夊箛椤旂厧濡洪梺缁樺笒椤兘寮婚敐澶婃闁割煈鍠楅崐顖炴⒑閸濆嫭顥為柣鈺婂灦瀵顓兼径濞€劑鏌ㄩ弬鍨挃妞ゆ柨娲ㄧ槐鎾存媴閻熺増鏆伴梺鐟板殩閹凤拷>>  闂傚倸鍊风欢姘缚瑜嶈灋婵°倕鎳忛崵鎰亜閺嶎偄浠滃鍛存⒑閹肩偛鍔楅柡鍛懇閹偞绻濋崶鈺佸絼闂佹悶鍎崝搴ㄥΥ閹烘鐓熼柟閭﹀墾閸旂喓绱掓潏銊ョ闁瑰嘲顑夐幖褰掝敃閵堝啫浠掗梻鍌欒兌鏋い鎴濇缁瑩骞掗弮鍌滅厯婵犮垼娉涢鍡涘磿閻斿吋鐓冮柕澶堝劚缁狙勪繆椤栨熬韬柡宀€鍠栧畷妤呭礂閻撳骸鏀俊鐐€戦崕鏌ュ箲閸ヮ兙鈧礁顫滈埀顒勭嵁閺嶃劍濯撮柣鐔碱暒閸濇姊绘担铏广€婇柛鎾寸箞瀹曟繆绠涘☉妯硷紱闂佸湱鍋撻崜姘跺触鐎n喗鐓曢柍鈺佸枤濞堟ɑ淇婇姘伃闁哄矉绲鹃幆鏃堝Ω閿斾粙鏁梻浣告啞閼归箖顢栨径鎰祦闁硅揪闄勯弲鎻掝熆鐠虹尨鍔熸い鏂挎嚇濮婃椽妫冨☉杈ㄢ枔闂佹悶鍔岀壕顓犲垝閸喎绶為柟閭﹀幘閸樹粙姊鸿ぐ鎺戜喊闁哥姵顨婂畷鐢稿焵椤掑嫭鈷戦柟鑲╁仜閳ь兙鍊濆畷鎶芥晲閸涱垱娈鹃梺璺ㄥ枔婵绮堥崘顔界厵缂備焦锚缁椻晜銇勯弬娆炬█婵﹨娅g划娆戞崉閵娧屽敹缂傚倷绀侀ˇ閬嶅礂濡櫣鏆︾憸鐗堝笒绾惧吋绻涢幋婵堬紞闁活厽顨婂铏瑰寲閺囩偛鈷夊銈冨妼閹虫劕顕ユ繝鍥ч敜婵°倓鑳堕崢浠嬫⒑闂堟稓绠為柛濠冪墪閳藉顦归柡宀嬬秮閸╁嫰宕橀鍛珰闂備浇顕栭崯顐﹀炊瑜旈崬鍫曟⒑缂佹ɑ顥堟い銉︽尰缁傛帡骞囬悧鍫㈠幗闁硅偐琛ラ崜婵堟嫻閿熺姵鐓曢悗锝庡€跨紓姘辩磼鏉堚晛浠ч柍褜鍓ㄧ紞鍡涘焵椤戞儳鐏╃紓宥咃躬瀵濡歌閸嬫捇鏁愭惔妯轰壕妞ゆ牓鍊栫€氾拷>>
闂傚倸鍊风欢姘缚瑜嶈灋婵°倕鎳忛崵鎰亜閺嶎偄浠滃鍛存⒑閹肩偛鍔楅柡鍛懇閹偞绻濋崶鈺佸絼闂佹悶鍎崝搴ㄥΥ閹烘鐓熼柟閭﹀墾閸旂喓绱掓潏銊ョ闁瑰嘲顑夐幖褰掝敃閵堝啫浠掗梻鍌欒兌鏋い鎴濇缁瑩骞掗弮鍌滅厯婵犮垼娉涢鍡涘磿閻斿吋鐓冮柕澶堝劚缁狙勪繆椤栨熬韬柡宀€鍠栧畷妤呭礂閻撳骸鏀俊鐐€戦崕鏌ュ箲閸ヮ兙鈧礁顫滈埀顒勭嵁閺嶃劍濯撮柣鐔碱暒閸濇姊绘担铏广€婇柛鎾寸箞瀹曟繆绠涘☉妯硷紱闂佸湱鍋撻崜姘跺触鐎n喗鐓曢柍鈺佸枤濞堟ɑ淇婇姘伃闁哄矉绲鹃幆鏃堝Ω閿斾粙鏁梻浣告啞閼归箖顢栨径鎰祦闁硅揪闄勯弲鎻掝熆鐠虹尨鍔熸い鏂挎嚇濮婃椽妫冨☉杈ㄢ枔闂佹悶鍔岀壕顓犲垝閸喎绶為柟閭﹀幘閸樹粙姊鸿ぐ鎺戜喊闁哥姵顨婂畷鐢稿焵椤掑嫭鈷戦柟鑲╁仜閳ь兙鍊濆畷鎶芥晲閸涱垱娈鹃梺璺ㄥ枔婵绮堥崘顔界厵缂備焦锚缁椻晜銇勯弬娆炬█婵﹨娅g划娆戞崉閵娧屽敹缂傚倷绀侀ˇ閬嶅礂濡櫣鏆︾憸鐗堝笒绾惧吋绻涢幋婵堬紞闁活厽顨婂铏瑰寲閺囩偛鈷夊銈冨妼閹虫劕顕ユ繝鍥ч敜婵°倓鑳堕崢浠嬫⒑闂堟稓绠為柛濠冪墪閳藉顦归柡宀嬬秮閸╁嫰宕橀鍛珰闂備浇顕栭崯顐﹀炊瑜旈崬鍫曟⒑缂佹ɑ顥堟い銉︽尰缁傛帡骞囬悧鍫㈠幗闁硅偐琛ラ崜婵堟嫻閿熺姵鐓曢悗锝庡€跨紓姘辩磼鏉堚晛浠ч柍褜鍓ㄧ紞鍡涘焵椤戞儳鐏╃紓宥咃躬瀵濡歌閸嬫捇鏁愭惔妯轰壕妞ゆ牓鍊栫€氾拷>>  闂傚倸鍊峰ù鍥綖婢跺⿴娓婚柛褎顨呴崒銊ノ旈敐鍛灕缂傚秵鐗楃换婵嬫濞戝崬鍓扮紒缁㈠幐閸嬫捇姊绘担鍛婃儓婵炲眰鍔嶉幈銊╂倻閼恒儱鍓归柟鍏肩暘閸斿秹鎮¢悩纰樺亾鐟欏嫭绀€婵炲眰鍊栫粋鎺楁晜閸撗咃紲婵炶揪绲介幗婊堝箺閻樼粯鐓欐い鏍ㄧ⊕椤ュ牓鏌℃担瑙勫磳闁轰焦鎹囬弫鎾绘晸閿燂拷-婵犵數濮烽弫鎼佸磿閹寸姴绶ら柦妯侯槺閺嗭附銇勯幒鎴濐仼闁活厽顨婇弻娑㈠焺閸愶紕绱板銈傛櫆閻擄繝寮诲☉銏犵労闁告劖鍎冲В鈧梻浣告贡閸庛倝骞愮紒妯碱洸闁靛牆妫涚粻楣冩煕閳╁叐鎴犱焊椤忓牊鐓冪憸婊堝礈濞嗘垹鐭撻柟缁㈠櫙缂嶆牠鏌曡箛瀣偓鏍疾閺屻儲鐓曟繛鎴濆船閺嬶箓鏌涘鐓庝喊婵﹨娅i幃浼村灳閸忓懎顥氶梻鍌欐祰瀹曠敻宕伴幇顒夌唵婵☆垵鍋愮粈濠傘€掑锝呬壕闂佸搫鐬奸崰鎾诲焵椤掍胶鈯曢柨姘舵煟韫囥儳绋荤紒缁樼箖缁绘繈宕橀妸褌娣俊鐐€栧ú鈺冪礊娓氣偓瀹曟椽鍩€椤掍降浜滈柟鐑樺灥閳ь剙鍢查埢浠嬵敂閸喓鍘搁梺鎼炲劗閺呮盯顢撶仦鍓х闁兼祴鏅涢埢鍫ユ煙椤旂瓔娈旈柍钘夘樀瀹曟ê顔忛钘夋灎闂傚倷鑳剁划顖炴偋閻愭祴鏋嶉柨婵嗘搐閸ㄦ繃鎱ㄥΟ鎸庣【缂佲偓閸緷褰掓晲閸涱喛纭€闂佸搫妫涙繛鈧慨濠冩そ閹兘骞嶉濠氬仐闂備胶枪椤戝棝骞戦崶顒€钃熼柨鐔哄Т闁卞洦銇勯幒宥囶槮妞ゅ骏鎷�>>
闂傚倸鍊峰ù鍥綖婢跺⿴娓婚柛褎顨呴崒銊ノ旈敐鍛灕缂傚秵鐗楃换婵嬫濞戝崬鍓扮紒缁㈠幐閸嬫捇姊绘担鍛婃儓婵炲眰鍔嶉幈銊╂倻閼恒儱鍓归柟鍏肩暘閸斿秹鎮¢悩纰樺亾鐟欏嫭绀€婵炲眰鍊栫粋鎺楁晜閸撗咃紲婵炶揪绲介幗婊堝箺閻樼粯鐓欐い鏍ㄧ⊕椤ュ牓鏌℃担瑙勫磳闁轰焦鎹囬弫鎾绘晸閿燂拷-婵犵數濮烽弫鎼佸磿閹寸姴绶ら柦妯侯槺閺嗭附銇勯幒鎴濐仼闁活厽顨婇弻娑㈠焺閸愶紕绱板銈傛櫆閻擄繝寮诲☉銏犵労闁告劖鍎冲В鈧梻浣告贡閸庛倝骞愮紒妯碱洸闁靛牆妫涚粻楣冩煕閳╁叐鎴犱焊椤忓牊鐓冪憸婊堝礈濞嗘垹鐭撻柟缁㈠櫙缂嶆牠鏌曡箛瀣偓鏍疾閺屻儲鐓曟繛鎴濆船閺嬶箓鏌涘鐓庝喊婵﹨娅i幃浼村灳閸忓懎顥氶梻鍌欐祰瀹曠敻宕伴幇顒夌唵婵☆垵鍋愮粈濠傘€掑锝呬壕闂佸搫鐬奸崰鎾诲焵椤掍胶鈯曢柨姘舵煟韫囥儳绋荤紒缁樼箖缁绘繈宕橀妸褌娣俊鐐€栧ú鈺冪礊娓氣偓瀹曟椽鍩€椤掍降浜滈柟鐑樺灥閳ь剙鍢查埢浠嬵敂閸喓鍘搁梺鎼炲劗閺呮盯顢撶仦鍓х闁兼祴鏅涢埢鍫ユ煙椤旂瓔娈旈柍钘夘樀瀹曟ê顔忛钘夋灎闂傚倷鑳剁划顖炴偋閻愭祴鏋嶉柨婵嗘搐閸ㄦ繃鎱ㄥΟ鎸庣【缂佲偓閸緷褰掓晲閸涱喛纭€闂佸搫妫涙繛鈧慨濠冩そ閹兘骞嶉濠氬仐闂備胶枪椤戝棝骞戦崶顒€钃熼柨鐔哄Т闁卞洦銇勯幒宥囶槮妞ゅ骏鎷�>>  濠电姷鏁搁崑鐐哄垂閸洖绠板┑鐘崇閸嬪绻濇繝鍌滃闁汇倗鍋撻妵鍕箛閸洘顎嶆繝娈垮灠閸氬绌辨繝鍥ч柛灞剧煯婢规洟姊绘担绛嬪殐闁哥姵顨呭嵄闁哄嫮鐏價mo Fisher闂傚倷娴囧畷鍨叏瀹ュ绀嬫い鎾跺枎閸ㄨ京绱撻崒娆戣窗闁革綆鍣e畷褰掓焼瀹撱儱娲︾€佃偐鈧稒锚閳ь剛鍏橀弻鐔封枔閸喗鐏撻梺纭呮珪閸旀瑩寮婚敐鍫㈢杸闁规儳澧庨澶娾攽椤旂》宸ユい顓犲厴閺佹劙鎮欓崫鍕敤濡炪倖鎸鹃崑鐔碱敊閸涘瓨鈷戦梺顐ゅ仜閼活垱鏅剁€涙﹩娈介柣鎰皺缁犱即鏌嶉挊澶樻Ц妤楊亙鍗抽崺鈧い鎺戝€搁崹婵囥亜椤忓嫷鍚檈ld Application Scientist闂傚倸鍊风欢姘缚瑜嶈灋闁哄啠鍋撻柟顖涙煥閵嗘帗绋婄花涔猼ing Develop缂傚倸鍊搁崐鐑芥倿閿斿墽鐭欓柟娆¤娲幖褰掝敃閵堝孩閿ら梺璇插缁嬫帟鎽繝娈垮灠椤曨參鍩€椤掆偓缁犲秹宕曟潏鈺傚床闁圭儤姊婚惌鍡楊熆閼搁潧濮堥柛瀣剁秮閺屾盯濡疯閸樺瓨淇婄紒銏犳珝闁哄本绋掗幆鏃堟晬閸曨収鍞洪梻浣哥秺椤ユ挻绻涢埀顒勬煛鐏炶濡块柍褜鍓ㄧ紞鍡涘礈濞嗗浚鍤曢柕濞炬櫆閳锋垶绻涢懠棰濆敽缂併劎绮妵鍕箣濠靛洤鏋犻悗娈垮櫘閸嬪﹪鐛Ο鑲╃<婵☆垵妗ㄧ純鏇㈡⒒娴gǹ鏆遍柟纰卞亰楠炲﹥寰勯幇顒傦紱闂佸湱鍋撻崜姘缚閳哄倶浜滈柟鏉垮閹吋绻濊鐎氭澘顫忔ウ瑁や汗闁圭儤鎸婚柨顓犵磽娴e壊妲告い鏇ㄥ幘閸掓帡鍩¢崨顓㈠敹闂佸搫娲ㄩ崑鐐茬暤瀹ュ鈷戠紓浣姑悘锕€鐣濋敐鍛仴鐎规洜鍎ゅ鍕箛椤撶姴骞楅梻浣稿暱閹碱偊鏁冮妶鍛瀺婵炲棙鍨圭壕濂告煙閹绘帩鍎愰悗姘炬嫹>>
濠电姷鏁搁崑鐐哄垂閸洖绠板┑鐘崇閸嬪绻濇繝鍌滃闁汇倗鍋撻妵鍕箛閸洘顎嶆繝娈垮灠閸氬绌辨繝鍥ч柛灞剧煯婢规洟姊绘担绛嬪殐闁哥姵顨呭嵄闁哄嫮鐏價mo Fisher闂傚倷娴囧畷鍨叏瀹ュ绀嬫い鎾跺枎閸ㄨ京绱撻崒娆戣窗闁革綆鍣e畷褰掓焼瀹撱儱娲︾€佃偐鈧稒锚閳ь剛鍏橀弻鐔封枔閸喗鐏撻梺纭呮珪閸旀瑩寮婚敐鍫㈢杸闁规儳澧庨澶娾攽椤旂》宸ユい顓犲厴閺佹劙鎮欓崫鍕敤濡炪倖鎸鹃崑鐔碱敊閸涘瓨鈷戦梺顐ゅ仜閼活垱鏅剁€涙﹩娈介柣鎰皺缁犱即鏌嶉挊澶樻Ц妤楊亙鍗抽崺鈧い鎺戝€搁崹婵囥亜椤忓嫷鍚檈ld Application Scientist闂傚倸鍊风欢姘缚瑜嶈灋闁哄啠鍋撻柟顖涙煥閵嗘帗绋婄花涔猼ing Develop缂傚倸鍊搁崐鐑芥倿閿斿墽鐭欓柟娆¤娲幖褰掝敃閵堝孩閿ら梺璇插缁嬫帟鎽繝娈垮灠椤曨參鍩€椤掆偓缁犲秹宕曟潏鈺傚床闁圭儤姊婚惌鍡楊熆閼搁潧濮堥柛瀣剁秮閺屾盯濡疯閸樺瓨淇婄紒銏犳珝闁哄本绋掗幆鏃堟晬閸曨収鍞洪梻浣哥秺椤ユ挻绻涢埀顒勬煛鐏炶濡块柍褜鍓ㄧ紞鍡涘礈濞嗗浚鍤曢柕濞炬櫆閳锋垶绻涢懠棰濆敽缂併劎绮妵鍕箣濠靛洤鏋犻悗娈垮櫘閸嬪﹪鐛Ο鑲╃<婵☆垵妗ㄧ純鏇㈡⒒娴gǹ鏆遍柟纰卞亰楠炲﹥寰勯幇顒傦紱闂佸湱鍋撻崜姘缚閳哄倶浜滈柟鏉垮閹吋绻濊鐎氭澘顫忔ウ瑁や汗闁圭儤鎸婚柨顓犵磽娴e壊妲告い鏇ㄥ幘閸掓帡鍩¢崨顓㈠敹闂佸搫娲ㄩ崑鐐茬暤瀹ュ鈷戠紓浣姑悘锕€鐣濋敐鍛仴鐎规洜鍎ゅ鍕箛椤撶姴骞楅梻浣稿暱閹碱偊鏁冮妶鍛瀺婵炲棙鍨圭壕濂告煙閹绘帩鍎愰悗姘炬嫹>>  闂傚倸鍊风粈渚€骞夐敓鐘茬鐟滅増甯掔粈鍫熺節闂堟侗鍎涢柡浣割儔閺屽秹宕崟顐熷亾鐟欏嫮顩查柕鍫濐槹閻撴洟鏌曟径瀣仴閻庢凹鍓氱粋宥夋焼瀹ュ棌鎷洪梺鍦瑰ù鐑藉Υ閹烘鐓曢柣妯挎珪缁€鍫㈢磼椤旇姤鈷掗柍褜鍓氱粙鎺曟懌婵炲瓨鍤庨崐婵嬪蓟閵娾晜鍋嗛柛灞剧☉椤忥拷14濠电姷鏁告慨浼村垂瑜版帗鍊堕柛顐犲劚閻ょ偓绻涢幋娆忕仾闁稿浜弻娑㈠即閵娿儱鈷掑┑鐐茬墢閺咁偊鍩€椤掆偓閸樻粓宕戦幘缁樼厓鐟滄粓宕滈悢鐓庣畺濞村吋娼欏敮闂佸疇妗ㄩ懗鍫曟偂閹达附鈷戦柟绋挎捣缁犳挻绻涚拠褏鐣甸柟顕€绠栭弻鍡楊吋閸℃瑥骞橀梻浣告啞閻熴儵藝鏉堚晝涓嶆慨妯垮煐閻撴洟鏌熼悙顒佺稇妞ゃ儱顑囩槐鎺撴綇閵娿儲璇為悗瑙勬礀瀹曨剟锝炲┑瀣垫晢闁逞屽墯閹便劑宕橀瑙f嫼闂佸湱枪妤犳悂宕伴弴銏$厵闁告垯鍊栫€氾拷>>
闂傚倸鍊风粈渚€骞夐敓鐘茬鐟滅増甯掔粈鍫熺節闂堟侗鍎涢柡浣割儔閺屽秹宕崟顐熷亾鐟欏嫮顩查柕鍫濐槹閻撴洟鏌曟径瀣仴閻庢凹鍓氱粋宥夋焼瀹ュ棌鎷洪梺鍦瑰ù鐑藉Υ閹烘鐓曢柣妯挎珪缁€鍫㈢磼椤旇姤鈷掗柍褜鍓氱粙鎺曟懌婵炲瓨鍤庨崐婵嬪蓟閵娾晜鍋嗛柛灞剧☉椤忥拷14濠电姷鏁告慨浼村垂瑜版帗鍊堕柛顐犲劚閻ょ偓绻涢幋娆忕仾闁稿浜弻娑㈠即閵娿儱鈷掑┑鐐茬墢閺咁偊鍩€椤掆偓閸樻粓宕戦幘缁樼厓鐟滄粓宕滈悢鐓庣畺濞村吋娼欏敮闂佸疇妗ㄩ懗鍫曟偂閹达附鈷戦柟绋挎捣缁犳挻绻涚拠褏鐣甸柟顕€绠栭弻鍡楊吋閸℃瑥骞橀梻浣告啞閻熴儵藝鏉堚晝涓嶆慨妯垮煐閻撴洟鏌熼悙顒佺稇妞ゃ儱顑囩槐鎺撴綇閵娿儲璇為悗瑙勬礀瀹曨剟锝炲┑瀣垫晢闁逞屽墯閹便劑宕橀瑙f嫼闂佸湱枪妤犳悂宕伴弴銏$厵闁告垯鍊栫€氾拷>>  生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
