
-

生物通官微
陪你抓住生命科技
跳动的脉搏
DPY30促进MLL复合物甲基转移酶活性的分子机制
【字体: 大 中 小 】 时间:2022年09月14日 来源:中国科学院生物化学与细胞生物学研究所
编辑推荐:
8月17日,国际学术期刊iScience在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈勇研究组的研究成果:“DPY30 acts as an ASH2L-specific stabilizer to stimulate the enzyme activity of MLL family methyltransferases on different substrates”,揭示了DPY30促进MLL复合物甲基转移酶活性的分子机制
8月17日,国际学术期刊iScience在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈勇研究组的研究成果:“DPY30 acts as an ASH2L-specific stabilizer to stimulate the enzyme activity of MLL family methyltransferases on different substrates”,揭示了DPY30促进MLL复合物甲基转移酶活性的分子机制。
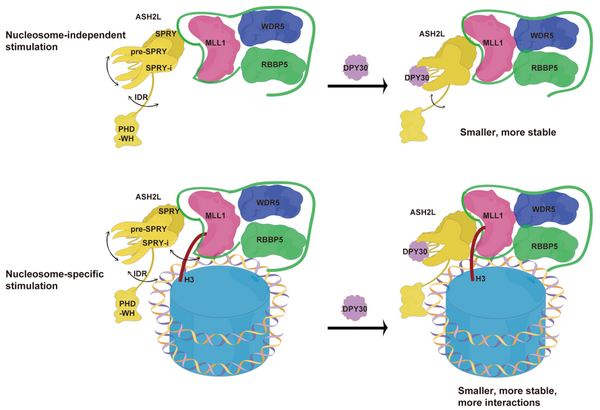
H3K4甲基化修饰对增强子活性调控、转录激活和细胞命运决定起关键作用,其异常会导致多种白血病和恶性肿瘤的发生。H3K4甲基化修饰主要是由MLL家族蛋白催化产生。MLL家族蛋白自身的甲基转移酶活性很低,需要与WDR5、RBBP5、ASH2L、DPY30等调节亚基形成复合物,才能有效发挥酶活。WDR5、RBBP5、ASH2L等亚基参与调控MLL蛋白酶活的分子机制在过去得到了充分的研究,但DPY30作为复合物中最小的蛋白(只有99个氨基酸)其发挥的作用和调节机制尚不明确。
在本项研究中,研究人员发现DPY30可以不同程度地增强MLL1复合物在不同底物上的活性。在核小体底物上,DPY30能提高MLL复合物的催化效率逾27倍;在组蛋白多肽、H3或组蛋白八聚体水平上,DPY30仅能提高催化效率约1.8倍。研究人员继而通过交联质谱、小角散射、结构预测、动力学模拟等多种方法阐明了DPY30通过多种机制来调控复合物的甲基转移酶活性。首先,DPY30与ASH2L的多个结构域结合,增加了ASH2L的结构紧致性和热稳定性;DPY30稳定后的ASH2L与RBBP5结合力增强,促进MLL1复合物组装形成一个更紧凑和更稳定的复合物,导致DPY30可以微调MLL1复合物在组蛋白多肽、H3、组蛋白八聚体上的酶活。其次,DPY30稳定后的ASH2L获得了与组蛋白H3 N端尾巴(1-40)和核小体DNA结合的新的作用界面,确保核小体H3的尾部准确且稳定地进入MLLSET的催化口袋,从而极大地促进MLL1复合物甲基化核小体的活性,揭示了DPY30特异性促进MLL1复合物在核小体上酶活的机制。
DPY30在多种癌症中高表达,前人研究表明DPY30的促癌效应与H3K4甲基化修饰相关。在癌细胞中敲低DPY30,H3K4甲基化修饰水平降低,癌细胞增殖减慢;回补DPY30,H3K4甲基化修饰水平增加,癌细胞增殖增快。所以本研究中揭示的DPY30调控MLL复合物甲基转移酶活性的分子机制可以为理解相关癌症发病机制提供理论基础,以及为相关癌症的治疗提供新的设计思路和设计靶点。
中科院分子细胞卓越中心博士生赵利杰为本文的第一作者,陈勇研究员为该论文的通讯作者。该研究工作获得中科院战略性先导计划和国家自然科学基金委的经费资助。该研究得到张江实验室国家蛋白质科学研究(上海)设施BL19U2小角散射线站、质谱分析系统和规模化蛋白质制备系统的支持和帮助。
文章链接:https://www.sciencedirect.com/science/article/pii/S2589004222012202
DPY30促进MLL复合物甲基转移酶活性的分子机制