
-

生物通官微
陪你抓住生命科技
跳动的脉搏
华中科技大学生命学院张新军团队发现小G蛋白RAB21调控细胞自噬与能量稳态
【字体: 大 中 小 】 时间:2022年08月30日 来源:华中科技大学生命与科学技术学院
编辑推荐:
2022年8月21日,华中科技大学生命科学与技术学院张新军教授团队在《Autophagy》杂志在线发表题为“RAB21 controls autophagy and cellular energy homeostasis by regulating retromer-mediated recycling of SLC2A1/GLUT1”的最新研究成果
2022年8月21日,华中科技大学生命科学与技术学院张新军教授团队在《Autophagy》杂志在线发表题为“RAB21 controls autophagy and cellular energy homeostasis by regulating retromer-mediated recycling of SLC2A1/GLUT1”的最新研究成果。该研究发现RAB21参与调控retromer介导的葡萄糖受体SLC2A1的逆向回膜转运,对维持细胞葡萄糖稳态及细胞自噬水平具有重要作用。

细胞的内吞体运输系统通过协调细胞内多重囊泡转运过程以实现细胞器之间的物质交换和信息传递,进而维持细胞稳态。进入内吞体的货物将面临两种命运:一是被运送到溶酶体进行降解;二是被分选回收并循环利用。二者之间的平衡对于维持细胞正常生理状态具有重要意义。其中,retromer复合体在介导内吞体货物的识别和逆向运输过程中发挥关键作用,如介导葡萄糖受体SLC2A1/GLUT1、肾上腺素能受体ADRB2等细胞膜受体向细胞膜转运,以及介导水解酶受体IGF2R/CI-M6PR、Wnt配体转运蛋白WLS等向高尔基体转运。Retromer复合体相关基因发生突变可导致神经退行性疾病如帕金森病(PD)等。
RAB蛋白家族是类Ras小G蛋白家族中最大的一个分支,目前已被报道的有60余种。RAB蛋白主要在细胞囊泡运输过程中发挥功能,通过GTP和GDP结合形式的转换,起到分子开关的作用,调控囊泡的出芽、形成、转运、锚着和融合。RAB21作为RAB家族的一员,被发现定位于早期内吞体(early endosome)上,但其生物学功能尚不明确。
首先,该研究发现RAB21基因敲除会导致细胞自噬流显著升高,且自噬体的清除(与溶酶体融合)效率也大幅提升。然而,提升的自噬流并不能增强细胞耐受饥饿等不良环境的能力,反而使细胞在各种应激条件下更快发生凋亡。通过这一反常现象,作者发现自噬上游的重要调控分子AMPK显著活化,并通过磷酸化其底物ULK1(参与自噬体形成的重要分子)导致自噬流升高。
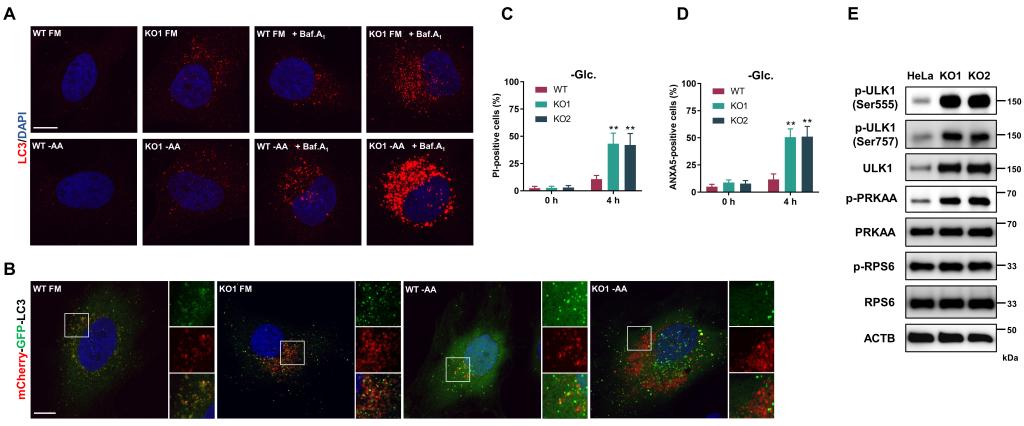
图1:RAB21敲除细胞自噬流升高,饥饿条件下凋亡率升高,AMPK通路活化,ULK1蛋白水平及磷酸化增加
AMPK通路是维持细胞能量稳态的核心枢纽,且其在众多营养物质中对葡萄糖尤为敏感,因此,作者推测RAB21敲除的细胞是否正在遭受营养(尤其是葡萄糖)缺失。由于RAB21定位于早期内吞体,作者首先检测了表达最为广泛的葡萄糖受体SLC2A1在细胞中的定位。结果显示,在正常细胞中,SLC2A1主要定位于细胞膜上,细胞中存在一些点状结构,但极少与溶酶体共定位;而在RAB21敲除的细胞中,大量的点状结构存在于细胞内部,且与溶酶体的共定位程度非常高,提示SLC2A1在内吞体上的分选与逆向回膜转运受到阻断,被错误地转运到溶酶体进行降解。通过葡萄糖摄取实验,作者不出意外地发现RAB21敲除细胞的葡萄糖摄取效率显著降低。
通过进一步研究,作者发现在RAB21敲除的细胞中,负责逆向运输的retromer复合体、WASH复合体,以及负责分选细胞膜受体的分选蛋白SNX27全部滞留在早期内吞体上,且RAB21敲除细胞中的早期內吞体形态发生显著变化,表现为体积增大且具有明显的管状结构。作者推测RAB21敲除导致早期内吞体上由retromer介导形成的分选小管一直处于出芽状态,无法与内吞体完成分裂,并最终导致内吞体上细胞膜受体无法逆向运输回细胞膜。
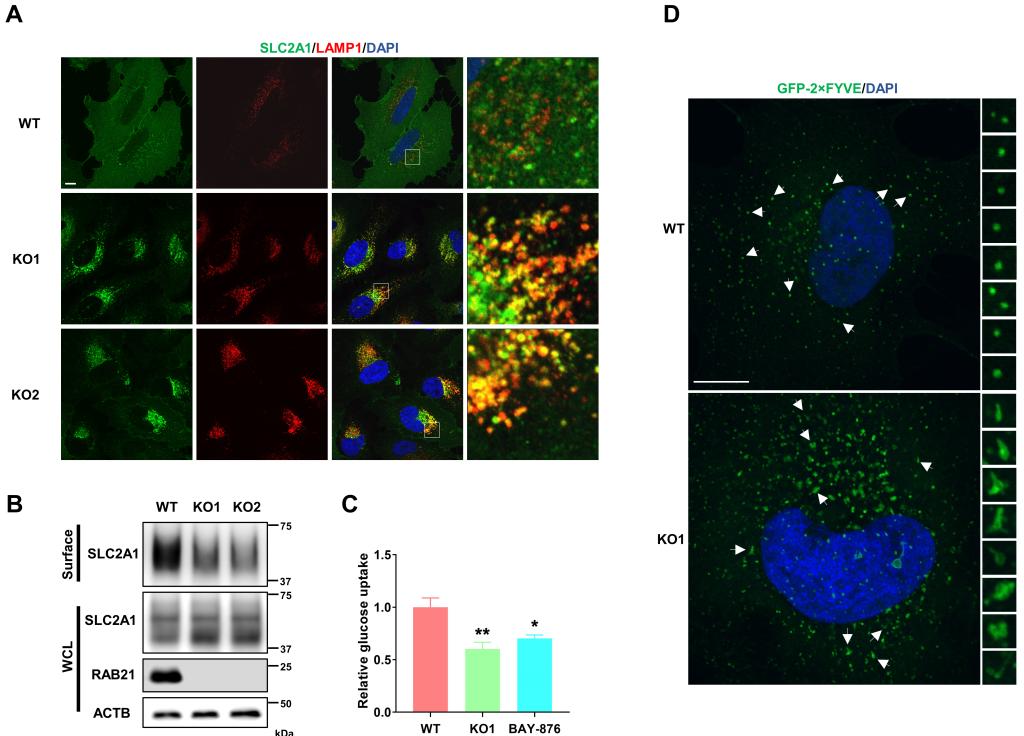
图2:RAB21敲除细胞中SLC2A1逆向运输受阻,细胞膜表面SLC2A1水平降低,细胞摄取葡萄糖效率降低,早期内吞体形态改变
最后通过肿瘤细胞异种移植实验,作者发现RAB21敲除细胞的成瘤率以及肿瘤的体积与质量显著低于野生型细胞,这使得RAB21成为继SLC2A1之后又一个肿瘤治疗的潜在靶点。
全文总结:在野生型细胞中,retromer复合体在RAB21的参与下介导细胞膜受体(如SLC2A1等)的逆向回膜运输,确保细胞高效摄取葡萄糖。RAB21缺失导致retromer介导形成的分选小管无法与早期內吞体解离,破坏SLC2A1的逆向回膜运输过程,继而影响细胞对葡萄糖的摄取,最终导致AMPK-ULK1通路的激活和细胞自噬流的升高。这项研究纠正了之前研究者对于RAB21蛋白在细胞自噬中的错误认知,同时为研究内吞体的动态变化和相关的囊泡转运机制提供了新的思路。

图3:RAB21参与retromer介导的细胞膜受体逆向运输
华中科技大学生命科学与技术学院博士研究生裴一飞和吕书凝为该论文共同第一作者。华中科技大学生命科学与技术学院张新军教授为该论文通讯作者。华中科技大学生命科学与技术学院张蓉颖教授、中南大学生命学院谭洁琼教授和南华大学医学院韩海龙博士参与了这项研究。这项研究还得到浙江大学孙启明教授、华中科技大学荣岳光教授、澳门大学路嘉宏教授、西安交通大学张义磊教授和四川大学贾大教授的支持和帮助。该研究得到中组部国家高层次人才计划青年项目和华中科技大学引进人才启动经费的资助。
论文链接:https://doi.org/10.1080/15548627.2022.2114271