
-

生物通官微
陪你抓住生命科技
跳动的脉搏
阿尔兹海默男性和女性患者的血液检测成分不同
【字体: 大 中 小 】 时间:2022年08月24日 来源:Mol Psychiatry
自古以来,衰老是每个人都无法逃避的人生历程。面对衰老,我们都希望优雅从容地老去。然而,有一种疾病给这种不美好的衰老蒙上了一层阴影,那就是阿尔茨海默病(AD),这是最主要的痴呆症类型。
多项研究发现,与男性相比,女性大脑和脑脊液中的AD病理生物标志物水平更高,与认知能力下降和神经退行性变的关联更强。这种相关性是否也存在于血液中的AD生物标志物仍然是未知的。最近,由加州大学圣地亚哥分校神经科学系的Sarah J. Banks领导的团队在《分子精神病学》杂志上发表了一项新研究。
Banks团队发现,尽管男性和女性的血浆p-tau181水平相似,但与男性相比,女性血浆p-tau181水平较高与较低的脑葡萄糖代谢、脑β淀粉样蛋白(Aβ)和内嗅皮质tau相关。本研究的结果表明,性别可能会影响血浆p-tau181浓度的临床解释。
如果这一结果在更大的人群样本中重现,这一发现将对血浆p-tau181作为AD生物标志物和预防和治疗临床试验的筛选工具具有重要的意义。

1906年,德国精神病学家和病理学家阿洛伊斯·阿尔茨海默(Alois Alzheimer)首次发现了AD,这是一种神经退行性疾病,发病缓慢,随时间推移逐渐恶化。目前,AD已成为一项全球医疗挑战,仅在美国65岁以上的成年人中就有九分之一以上受到影响。阿尔茨海默病的病因尚不清楚,有几种不同的假说试图解释阿尔茨海默病的病因。一个主流的病因解释是1991年提出的Aβ假说,认为Aβ在大脑中的沉积可能是AD[3]的根本原因。此外,Tau蛋白假说认为,Tau蛋白异常是AD疾病发展[4]的主要原因。
虽然Aβ正电子发射断层扫描和脑脊液检测极大地提高了AD诊断的准确性和预后[5-7],但这些方法不仅价格昂贵,而且具有侵袭性,在临床实践上的应用很大程度上困难。因此,AD患者血液中的生物标志物可能是潜在的替代物[8]。
最近的研究表明血浆p-tau181可以识别AD个体,区分a β阳性和a β阴性个体,其准确性可与已建立的AD生物标志物预测方法[9]相媲美。此外,通过[18 F] Flortaucipir正电子发射断层扫描(FTP-PET)[10]发现,较高的基线血浆p-tau181与较高的皮质tau蛋白水平相关。
不仅如此,越来越多的证据表明,与男性[12]相比,患有AD梯度的女性的脑脊液和tau蛋白水平更高。一项尸检研究发现,tau病理学每增加1个单位,女性临床AD的几率就会增加13倍,而男性[13]的几率只会增加1.4倍。另一项研究表明,在脑脊液tau蛋白水平较高的个体中,女性海马萎缩更明显,执行功能下降比男性[14]更快。结合先前的证据显示tau蛋白沉积与AD临床表现[15]之间存在很强的相关性,女性tau病理数量的增加以及对tau病理易感性的增加可能导致更显著的认知能力下降[16]。然而,尚不清楚血浆p-tau181是否存在类似的性别差异,以及它与认知能力下降、AD风险和其他AD生物标志物的相关性。
有鉴于此,Banks小组试图回答下列三个问题:
①具有认知和临床梯度的个体血浆p-tau181的横断面和纵向水平是否因性别不同而有差异;
②性别是否会改变血浆p-tau181与脑脊液p-tau181、脑内Aβ沉积、糖代谢和tau沉积的关系;
③性别是否影响血浆p-tau181基线水平对AD痴呆认知能力下降及进展的影响。
为了回答这些问题,Banks团队使用了AD神经成像计划(ADNI)数据库。该分析的数据来自神经影像实验室(LONI)数据库(ida.loni.usc.edu),于2021年6月获得。研究样本包括1060名参与者,其中494名女性(46.7%)和566名男性(53.4%)。其中,359例(33.9%)认知正常,516例(48.7%)诊断为轻度认知障碍,185例(17.5%)诊断为痴呆,560例(52.8%)Aβ阳性。
研究样本以白人为主(92.6%),平均年龄为73.8岁,平均受教育程度为16.2年。
与男性相比,样本中的女性更年轻,受教育年限更少,CSF p-tau181和脑葡萄糖代谢水平更高,更有可能认知正常,更不可能出现轻度认知障碍或痴呆(表1)。为了解释诊断状态的性别差异,我们在后续分析中对诊断效果进行了额外调整。
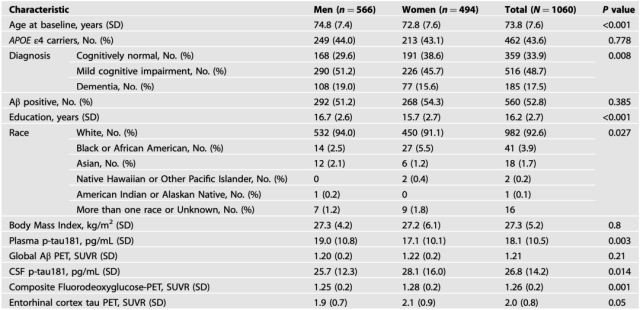
表1按性别划分的基线人口统计学和临床样本特征
研究结果显示,在整个队列和任何分层组中,男性和女性的基线血浆p-tau181水平没有显著差异,血浆p-tau181随时间的变化率在整个队列和分层组中也没有性别差异。也就是说,两性之间的血浆p-tau181浓度相似。
那么在AD发病过程中,性别有什么不同呢?
Banks的研究小组发现,虽然两性血浆中p-tau181的浓度相似,但女性的表型生物标志物水平更差。与男性相比,表型生物标志物与女性血浆p-tau181浓度升高有关。具体而言,与男性相比,女性血浆p-tau181水平较高与更大的皮质Aβ沉积、脑脊液中更高浓度的p-tau181、更大的内嗅皮质tau沉积和更低的脑葡萄糖代谢有关。此外,与男性相比,女性的认知能力下降更快,转变为痴呆症的风险更大,这与较高的基线血浆p-tau181水平有关。值得注意的是,这些性别差异在a β阳性参与者和轻度认知障碍的个体中可见,但在痴呆症患者中没有。
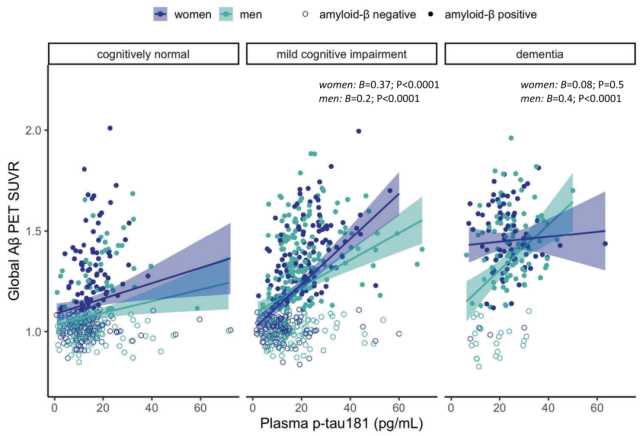
性别调节血浆p-tau181与脑Aβ沉积的关系
Banks团队还发现,a β阳性的女性与a β阳性的男性相比,与较高的基线血浆p-tau181相关的更高的痴呆症发病率。
这一发现与之前的研究一致。例如,有研究表明,在大脑和脑脊液tau负荷升高的情况下,女性的认知衰退轨迹更快,临床AD诊断率比男性更高[13,14];研究表明,尽管女性在AD的早期病理阶段表现出更强的认知弹性,但她们在病理较晚期[17]的临床衰退更快。因此,本研究中a β阳性和轻度认知障碍组的部分女性可能突破了AD轨迹的临界点,临床症状开始加速。总的来说,Banks团队的研究结果表明,性别可能会影响血浆p-tau181浓度的临床解释。
尽管男性和女性血浆p-tau181水平相似,但与男性相比,女性血浆p-tau181水平较高与较低的脑糖代谢、更多的a β和内嗅皮层tau沉积以及更高的CSF p-tau181水平相关,它与认知能力下降更快有关。
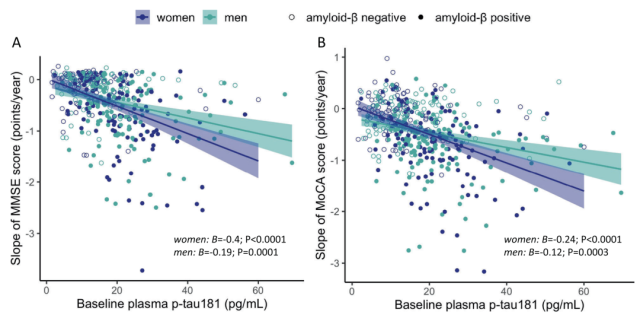
性别调节血浆p-tau181与认知改变的关系
需要指出的是,本研究具有一定的局限性。研究样本主要由非西班牙裔白人参与者组成,这限制了研究结果的普遍性。先前的研究已经表明,不同种族和民族的AD临床轨迹的性别差异是不同的,未来的研究应该研究性别是否会影响不同人群样本血浆p-tau181浓度的临床解释。此外,本研究内嗅皮层tau沉积是通过PET扫描获得的,但数年后测量血浆p-tau181。尽管研究人员根据这一时滞调整了他们的模型,但他们无法得出血浆p-tau181水平与皮层tau沉积之间关系的时间性质的结论。
如果这项研究的结论得到进一步的证实,在未来,也许通过检测血浆p-tau181的潜在性别差异,可以开发出性别特异性指南,也可以作为临床试验的筛选工具,并作为预防AD的生物标志物。
参考文献
[1]Tsiknia AA, Edland SD, Sundermann EE, et al. Sex differences in plasma p-tau181 associations with Alzheimer’s disease biomarkers, cognitive decline, and clinical progression [published online ahead of print, 2022 Jun 29]. Mol Psychiatry. 2022 ;10.1038/s41380-022-01675-8. doi:10.1038/s41380-022-01675-8
[2] alzheimers-facts-and-figures.pdf. 2021. https://www.alz.org/media/documents/alzheimers-facts-and-figures.pdf
[3] Hardy J, Allsop D. Amyloid deposition as the central event in the aetiology of Alzheimer’s disease. Trends Pharmacol Sci. 1991;12(10):383-388. doi:10.1016/0165-6147(91)90609-v
[4] Mudher A, Lovestone S. Alzheimer’s disease-do tauists and baptists finally shake hands?. Trends Neurosci. 2002;25(1):22-26. doi:10.1016/s0166-2236(00)02031-2
[5] Skillb?ck T, Farahmand BY, Rosén C, et al. Cerebrospinal fluid tau and amyloid-β1-42 in patients with dementia. Brain. 2015;138(Pt 9):2716-2731. doi:10.1093/brain/awv181
[6]Hansson O, Zetterberg H, Buchhave P, Londos E, Blennow K, Minthon L. Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study [published correction appears in Lancet Neurol. 2006 Apr;5(4):293]. Lancet Neurol. 2006;5(3):228-234. doi:10.1016/S1474-4422(06)70355-6
[7] Hanseeuw BJ, Betensky RA, Jacobs HIL, et al. Association of Amyloid and Tau With Cognition in Preclinical Alzheimer Disease: A Longitudinal Study [published correction appears in JAMA Neurol. 2019 Aug 1;76(8):986]. JAMA Neurol. 2019;76(8):915-924. doi:10.1001/jamaneurol.2019.1424
[8]Molinuevo JL, Ayton S, Batrla R, et al. Current state of Alzheimer’s fluid biomarkers. Acta Neuropathol. 2018;136(6):821-853. doi:10.1007/s00401-018-1932-x
[9]Karikari TK, Benedet AL, Ashton NJ, et al. Diagnostic performance and prediction of clinical progression of plasma phospho-tau181 in the Alzheimer’s Disease Neuroimaging Initiative. Mol Psychiatry. 2021;26(2):429-442. doi: 10.1038/s41380-020-00923-z
[10]Moscoso A, Grothe MJ, Ashton NJ, et al. Time course of phosphorylated-tau181 in blood across the Alzheimer’s disease spectrum [published correction appears in Brain. 2021 Jul 28;144(6):e57]. Brain. 2021 ;144(1):325-339.doi:10.1093/brain/awaa399
[11] Takeda S. Tau Propagation as a Diagnostic and Therapeutic Target for Dementia: Potentials and Unanswered Questions. Front Neurosci. 2019;13:1274. Published 2019 Dec 13. doi:10.3389/fnins.2019.01274
[12] Shokouhi S, Taylor WD, Albert K, Kang H, Newhouse PA; Alzheimer’s Disease Neuroimaging Initiative. In vivo network models identify sex differences in the spread of tau pathology across the brain. Alzheimers Dement (Amst). 2020;12( 1): e12016. Published 2020 Apr 9. doi: 10.1002/dad2.12016
[13] Barnes LL, Wilson RS, Bienias JL, Schneider JA, Evans DA, Bennett DA. Sex differences in the clinical manifestations of Alzheimer disease pathology. Arch Gen Psychiatry. 2005;62(6):685-691. doi:10.1001 /archpsyc.62.6.685
[14] Koran MEI, Wagener M, Hohman TJ; Alzheimer’s Neuroimaging Initiative. Sex differences in the association between AD biomarkers and cognitive decline. Brain Imaging Behav. 2017;11(1):205-213. doi:10.1007/s11682-016 -9523-8
[15] Ossenkoppele R, Schonhaut DR, Sch?ll M, et al. Tau PET patterns mirror clinical and neuroanatomical variability in Alzheimer’s disease. Brain. 2016;139(Pt 5):1551-1567. doi:10.1093/brain/aww027
[16] Buckley RF, Scott MR, Jacobs HIL, et al. Sex Mediates Relationships Between Regional Tau Pathology and Cognitive Decline. Ann Neurol. 2020;88(5):921-932. doi:10.1002/ana.25878
[17] Sundermann EE, Biegon A, Rubin LH, et al. Better verbal memory in women than men in MCI despite similar levels of hippocampal atrophy. Neurology. 2016;86(15):1368-1376. doi:10.1212/WNL. 0000000000002570
[18]Avila JF, Vonk JMJ, Verney SP, et al. Sex/gender differences in cognitive trajectories vary as a function of race/ethnicity. Alzheimers Dement. 2019;15(12):1516-1523. doi:10.1016/j .jalz.2019.04.006
Molecular Psychiatry: Blood tests for Alzheimer’s disease are different for men and women!
(source:internet, reference only)