
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Rep:自噬受体蛋白p62调控DNA损伤修复的新机制
【字体: 大 中 小 】 时间:2022年07月22日 来源:北京大学基础医学院
编辑推荐:
2022年7月19日,北京大学基础医学院罗建沅/王海英团队在Cell Reports杂志上在线发表了题为Acetylation of p62 regulates base excision repair through interaction with APE1的研究论文,报道了hMOF和SIRT7动态调控p62 K264位点的乙酰化,乙酰化的p62通过促进BER通路中的关键酶APE1染色质募集和酶活性,从而促进碱基切除修复
基因组每时每刻都遭受着来自内外源各种因素引起的DNA损伤。机体通过不同的DNA修复机制来纠正和修复损伤,维持基因组稳定性。碱基切除修复(BER)是机体维持基因组稳定的一线修复途径,可以有效地修复多种DNA损伤类型,包括各种DNA碱基损伤和单链断裂。作为细胞抵抗损伤的主要防御手段,BER过程的失调或功能障碍与多种疾病密切相关,包括神经退行性疾病、衰老、肿瘤和化疗抵抗等。尽管BER的各个步骤已经基本清楚,但BER组分的动态调控在很大程度上仍是未知的。
2022年7月19日,北京大学基础医学院罗建沅/王海英团队在Cell Reports杂志上在线发表了题为Acetylation of p62 regulates base excision repair through interaction with APE1的研究论文,报道了hMOF和SIRT7动态调控p62 K264位点的乙酰化,乙酰化的p62通过促进BER通路中的关键酶APE1染色质募集和酶活性,从而促进碱基切除修复。

研究人员发现敲除p62的细胞对氧化剂和烷化剂更为敏感,表明p62是BER有效修复所必需的。当烷化剂甲磺酸甲酯诱导DNA损伤时,p62乙酰化水平升高。通过质谱分析鉴定及体内和体外的乙酰化、去乙酰化实验发现hMOF为p62 K264位点的乙酰基转移酶,SIRT7为其去乙酰化酶。接着通过染色质组分分离,APE1酶活性测定等实验,研究人员发现p62 K264乙酰化在BER中发挥重要的调控作用。乙酰化的p62与APE1相互作用并促进APE1染色质募集和提高APE1的脱碱基核酸内切酶活性,从而提高BER效率,促进细胞存活。
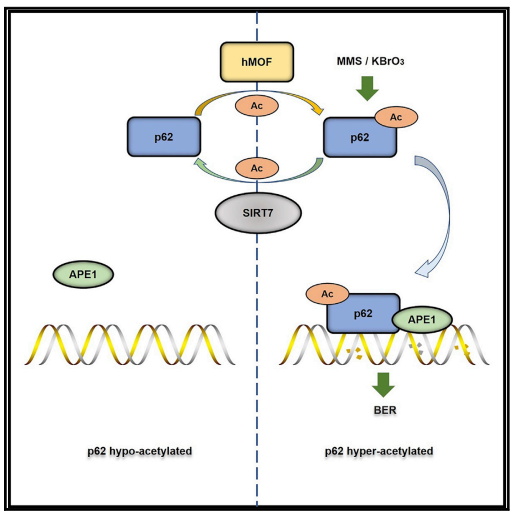
p62作为细胞自噬的重要受体蛋白,之前的研究发现其参与调控DNA双链损伤修复,本研究发现了hMOF和SIRT7共同调控p62 K264位点的乙酰化,从而调控碱基切除修复的新机制。这项研究不仅为p62在DNA损伤修复中的作用提供了新的证据,也为基于DNA损伤修复机制研发的药物提供新的研究方向,给有效治疗疾病提供了新线索。
北京大学医学部博士后李美婷,基础医学院硕士熊健楠为该文章的共同第一作者,北京大学王海英副教授和罗建沅教授为该工作的共同通讯作者。该工作得到了国家自然科学基金面上项目、国家重点基础研究计划和北京大学医学科技创新平台发展基金—医学交叉种子基金资助项目的支持。
原文链接:https://doi.org/10.1016/j.celrep.2022.111116
(北京大学基础医学院)