
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Arraystar circRNA芯片助力结直肠癌转移机制研究
【字体: 大 中 小 】 时间:2022年06月20日 来源:康成生物
编辑推荐:
该文章应用Arraystar Human circRNA 芯片发现circALG1在CRC 患者的癌组织和外周血中均高表达, circALG1的m6A修饰增强了circRNA与miR-342-5p的结合能力,circALG1通过 miR-342-5p/PGF 信号轴促进 CRC 转移。

近期,中南大学湘雅三医院胃肠外科研究团队发表研究成果“The N6-methyladenosine modifcation of circALG1 promotes the metastasis of colorectal cancer mediated by the miR-342-5p/PGF signalling pathway”。该文章应用Arraystar Human circRNA 芯片发现circALG1在CRC 患者的癌组织和外周血中均高表达, circALG1的m6A修饰增强了circRNA与miR-342-5p的结合能力,circALG1通过 miR-342-5p/PGF 信号轴促进 CRC 转移。这些实验结果表明circALG1可以作为早期诊断和抗肿瘤转移治疗的潜在靶点。研究成果于2022年5月发表在国际著名学术期刊《Molecular Cancer》(IF: 27.0401)上。 (Arraystar Human circRNA芯片由康成生物丨数谱生物提供技术服务)。

研究背景
环状 RNA (circRNA) 是闭环非编码 RNA,缺乏 5' 帽结构和多聚 (A) 尾。有研究发现结直肠癌(CRC)患者血浆中 circRNA 的表达水平与健康个体血浆中的表达水平存在显著差异,这表明 circRNA 可作为新的 CRC 诊断标志物。通过研究circRNAs在CRC发生发展中的调控作用,研究人员发现竞争性内源性RNAs(ceRNAs)机制是circRNAs发挥调控功能的主要方式之一,例如circHIPK3 在 CRC中高度表达。高表达的circHIPK3可以与miR-7竞争性结合,解除miR-7对下游靶基因的抑制作用,促进CRC细胞的增殖、迁移和侵袭;因此,这种 circRNA 是 CRC 的潜在治疗靶点。
m6A修饰是RNA最常见的表观遗传修饰,影响pre-RNA剪切,调节RNA核输出,促进RNA翻译,影响RNA稳定性,增强RNA与miRNA的结合。这种修饰在 circRNA 中也很常见,并影响包括 CRC 在内的多种疾病的进展。然而,m6A修饰是否调节circRNAs的ceRNA机制仍不清楚。
技术路线
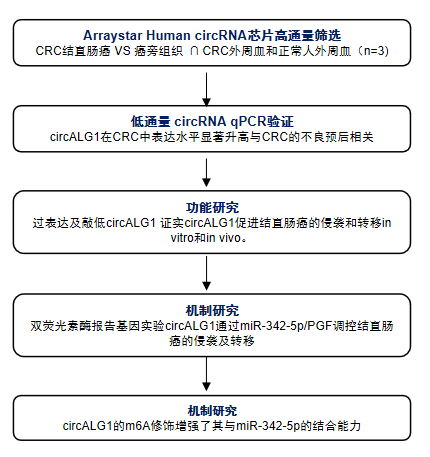
研究思路
高通量筛选
研究者使用Arraystar Human circRNA 芯片检测了3对结直肠癌 (CRC) 患者的癌和癌旁组织以及3对CRC患者和健康个体的外周血样本中 circRNA 的表达谱,筛选了在CRC患者肿瘤组织和外周血中高表达的2个circRNA circALG1和circCOL6A3,其中circALG1不仅在结直肠癌患者的肿瘤组织和外周血高表达,且与结直肠癌转移密切相关。
功能研究
In vitro过表达circALG1促进了CRC细胞的迁移和侵袭,敲低circALG1抑制了CRC细胞的迁移和侵袭。In vivo实验证实了 circALG1 影响CRC 的肝转移和肺转移。
机制研究
SRAMP预测及MeRIP验证发现,circALG1具有m6A修饰。M6A修饰位点突变实验表明,circALG1 m6A修饰改变影响肿瘤细胞转移侵袭能力。ceRNA分析、circALG1 RAP和双荧光素酶报告基因实验表明,circALG1 通过与 miR-342-5p 结合上调PGF的表达;circALG1 RAP、m6A位点突变荧光素酶实验和YTHDF1 RIP等实验表明,m6A 修饰增强了 circALG1 与 miR-342-5p 的结合并促进其 ceRNA 功能。
结果展示
1.高通量筛选:在结直肠癌组织及癌旁组织,结直肠癌和正常人外周血中通过Arraystar human circRNA芯片筛选后取交集
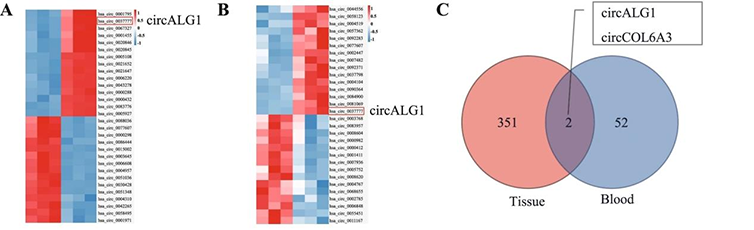
图1:聚类图显示Arraystar human circRNA芯片检测3对结直肠癌患者的癌组织和癌旁组织中circRNA的表达。聚类图显示Arraystar human circRNA芯片检测3对正常个体和CRC患者外周血样本中circRNA的表达。韦恩图显示CRC组织和外周血中高表达的circRNA交集。
2、低通量验证及circRNA的鉴定
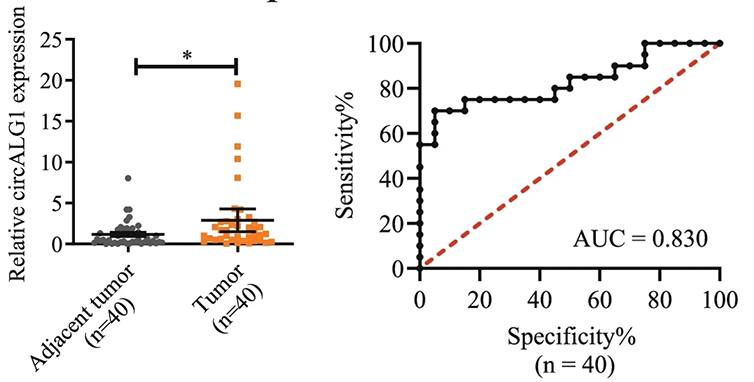
图2:qRT-PCR 验证 40对CRC癌和癌旁组织中 circALG1 的表达水平升高。ROC曲线说明 circALG1表达水平可以很好的区分CRC癌和癌旁组织
3、功能研究:过表达或敲低circALG1 促进或抑制结直肠癌的侵袭和转移。
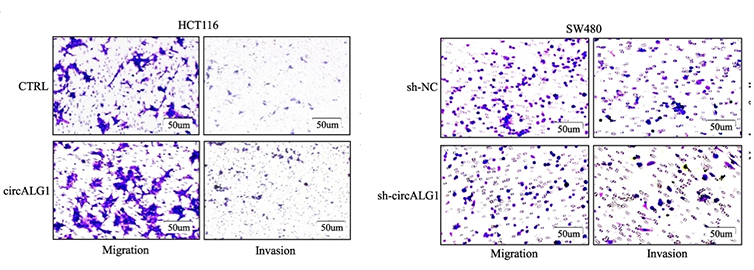
图3:左图,transwell小室实验证明在HCT116细胞中过表达circALG1促进结直肠癌的侵袭。右图,transwell小室实验证明在SW480细胞中敲低circALG1抑制结直肠癌的侵袭和转移。
4、机制研究:m6A修饰增强circALG1结合miR-342-5p,并通过miR-342-5p/PGF调控结直肠癌的侵袭及转移

图4:左图双荧光素酶报告基因实验表明,突变circALG1 m6A修饰位点会抑制circALG1与miR-342-5p的结合;右图显示miR-342-5p序列结合PGF ,通过双荧光素酶实验证明mir-342-5p可以结合PGF。
5、研究机制图
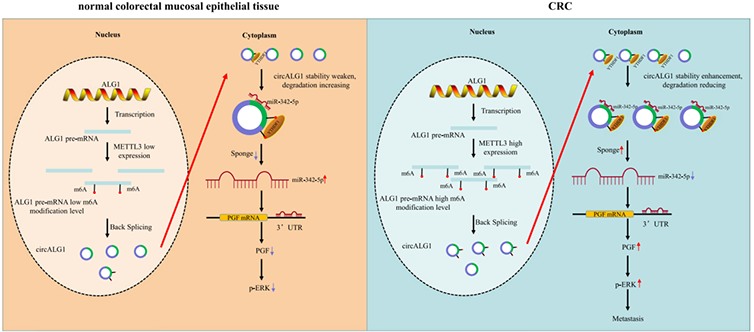
图5:研究机制图
CircALG1 通过与 miR-342-5p 竞争性结合,解除 miR-342-5p 对 PGF mRNA 表达的抑制作用,并促进 PGF 表达,从而增强对 CRC 的侵袭。METTL3在CRC中的高表达增加了ALG1前mRNA的m6A修饰水平,进而增加了cirALG1的m6A修饰水平。circALG1的 m 6 A 修饰增强了其与 miR-342-5p 结合的能力,并通过增强其稳定性来促进 circALG1 ceRNA 作用。
结论
通过Arraystar Human circRNA芯片筛选发现circALG1在CRC患者的癌组织和外周血中均高表达, circALG1通过miR-342-5p/PGF信号轴促进CRC转移。circALG1的m6A修饰增强了该circRNA与miR-342-5p的结合能力,进一步促进了其ceRNA机制。这些实验结果表明circALG1可以作为早期诊断和抗肿瘤转移治疗的潜在靶点。
文章链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01560-6
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
