
-

生物通官微
陪你抓住生命科技
跳动的脉搏
O-GlcNAc修饰调控神经突触相分离新机制
【字体: 大 中 小 】 时间:2022年06月17日 来源:北京大学新闻网
编辑推荐:
陈兴课题组与北京大学药学院董甦伟课题组、张明杰课题组等合作,利用化学半合成策略构建了特定位点具有O-GlcNAc修饰的SynGAP蛋白,阐明了O-GlcNAc修饰对SynGAP/PSD95液–液相分离过程的调控和分子机制。

细胞作为生物体生命活动的基本单元,为了不被干扰地同时进行多种复杂的生化反应,演化出许多膜包被的细胞器——如细胞核、内质网、高尔基体、线粒体等——对异质性的生化过程进行区块化的分隔,保证不同的反应在特定的区域内高效、有序地完成。除了膜包被的细胞器外,还存在一类无膜包被或者半膜包被的可以富集生物大分子的结构,例如核仁、应激颗粒(Stress granule),以及神经元中的突触后致密区(postsynaptic density, PSD)等1–3。近年来,这些结构的形成原理和功能在科学界引起了极大的关注,人们发现这类结构一般是通过蛋白-蛋白或蛋白-RNA相互作用形成液–液相分离(Liquid-liquid phase separation, LLPS)产生的。LLPS主要以不同蛋白结构域、蛋白内在无序区(intrinsicdisorderedregion)以及蛋白-RNA间形成的多价相互作用为驱动力而发生2。无膜或半膜细胞器在细胞中发挥重要的功能,相比于传统的膜包被的细胞器,它们可以更高效地与外界环境发生物质交换,同时保障结构内的物质在细胞内处于相对独立的空间,其组成与浓度可以被精确调控。目前,针对LLPS在生理及病理状态下的功能研究已取得诸多突破性成果,LLPS已被证明在基因表达调控4、细胞对外在环境的压力响应5、先天免疫应答6、神经退行性疾病的发生7等方面均发挥重要作用。基于这些成果,对液–液相分离过程的精准时空调控及其分子机制的研究也方兴未艾。
蛋白的翻译后修饰(post-translationalmodifications, PTMs)可以通过改变氨基酸残基间的相互作用强度实现对液-液相分离体系的动态调控8。例如,精氨酸甲基化修饰通过减弱其与芳香氨基酸间的相互作用抑制Ddx4、hnRNPA2、FUS和FMRP等蛋白形成LLPS9–13;磷酸化修饰可以在不同的相分离体系起到截然相反的调控作用,如Tau7和FMRP14蛋白的磷酸化修饰促进其发生LLPS,而FUS和TDP-43的LLPS过程受磷酸化修饰抑制15,16。
尽管多种翻译后修饰已被阐明可以参与LLPS的调控,糖基化修饰——一种广泛存在于高等生物细胞中的翻译后修饰——对LLPS的调控作用却始终未被系统研究和阐释。O-GlcNAc修饰是存在于胞内蛋白丝氨酸和苏氨酸残基上的糖基化修饰,在哺乳动物大脑中广泛分布,其修饰酶OGT在兴奋性神经元PSD中大量富集17,18。北京大学化学与分子工程学院、北大-清华生命科学联合中心陈兴课题组一直致力于解析糖基化修饰在不同器官与组织中的分布和生物学功能。他们发现,PSD的重要组成蛋白SynGAP具有多个O-GlcNAc修饰位点。此前,香港科技大学(现南方科技大学生命科学学院)的张明杰课题组发现,SynGAP与PSD中的脚手架蛋白PSD-95所形成的复合物可发生液-液相分离,且该LLPS过程对于PSD的形成和功能具有重要意义19,20。基于此,陈兴课题组与北京大学药学院、天然药物及仿生药物国家重点实验室董甦伟课题组以及张明杰课题组等合作,利用化学半合成策略构建了特定位点具有O-GlcNAc修饰的SynGAP蛋白,阐明了O-GlcNAc修饰对SynGAP/PSD95液–液相分离过程的调控和分子机制,相关成果以“O-GlcNAcylation modulates liquid–liquid phase separation of SynGAP/PSD-95”为题于2022年5月30日发表在Nature Chemistry杂志。
在所鉴定到的众多O-GlcNAc修饰位点中,他们选定了位于SynGAP蛋白CC-PBM结构域1159位丝氨酸(S1159)与1306位苏氨酸(T1306)两个位点进行深入研究,因为CC-PBM结构域通过与PSD-95蛋白PSG结构域的相互作用形成LLPS(图1a)。利用表达蛋白连接(expressed protein ligation,EPL)策略,他们合成了S1159与T1306位点特异O-GlcNAc修饰的SynGAPCC-PBM蛋白(SynGAP-S1159OG & SynGAP-T1306OG,图1b)。接着,通过液滴成像实验与沉淀离心实验,证明了SynGAP-T1306OG可以完全抑制LLPS形成(图1c)。结合同源结构模拟与体积排阻-静态光散射分析,他们提出SynGAP蛋白T1306位点的O-GlcNAc修饰通过阻碍T1306与PSD-95蛋白369位组氨酸(H369)间形成氢键,破坏蛋白相互作用进而阻碍LLPS形成,并在细胞内验证了该机理(图1d-e)。

图1. SynGAP蛋白O-GlcNAc位点鉴定,蛋白合成与抑制LLPS机理
O-GlcNAc修饰通常是亚化学计量,即修饰率不足100%。那么,亚化学计量的O-GlcNAc修饰能否有效地调控LLPS便是一个重要的问题。他们通过调整合成蛋白中O-GlcNAc修饰比例,模拟不同修饰率对LLPS的影响,结果显示不同修饰率(10% ~ 100%)均可以对LLPS产生不同程度的抑制。同时,与通过降低蛋白浓度抑制LLPS的方式相比,等比例的O-GlcNAc修饰对LLPS具有更明显的抑制效果,即O-GlcNAc对于LLPS的抑制呈现出显性负调控(dominant-negative effect)的特征(图2a-b)。此外,O-GlcNAc修饰对LLPS的抑制是动态可逆的,通过加入O-GlcNAc转移酶OGT或去修饰酶OGA可以动态地调节O-GlcNAc水平与LLPS阈值(图2c)。
陈兴课题组长期致力于糖化学和糖生物学研究,神经系统中的蛋白质糖基鉴定与功能研究是目前的重点方向之一。本工作利用化学半合成策略与多种技术手段,详细阐明了特定位点O-GlcNAc修饰对SynGAP/PSD-95液–液相分离的调控作用,揭示了O-GlcNAc修饰在该体系中显性负调控的作用方式和抑制LLPS发生的分子机制,证明了OGT/OGA对该过程的动态调控。该发现为诠释O-GlcNAc修饰在调控神经系统发育与突触可塑性等过程中的重要功能提供一个新的机制。同时,O-GlcNAc修饰可能作为一种普适性的调控机制,调控多种液–液相分离过程。
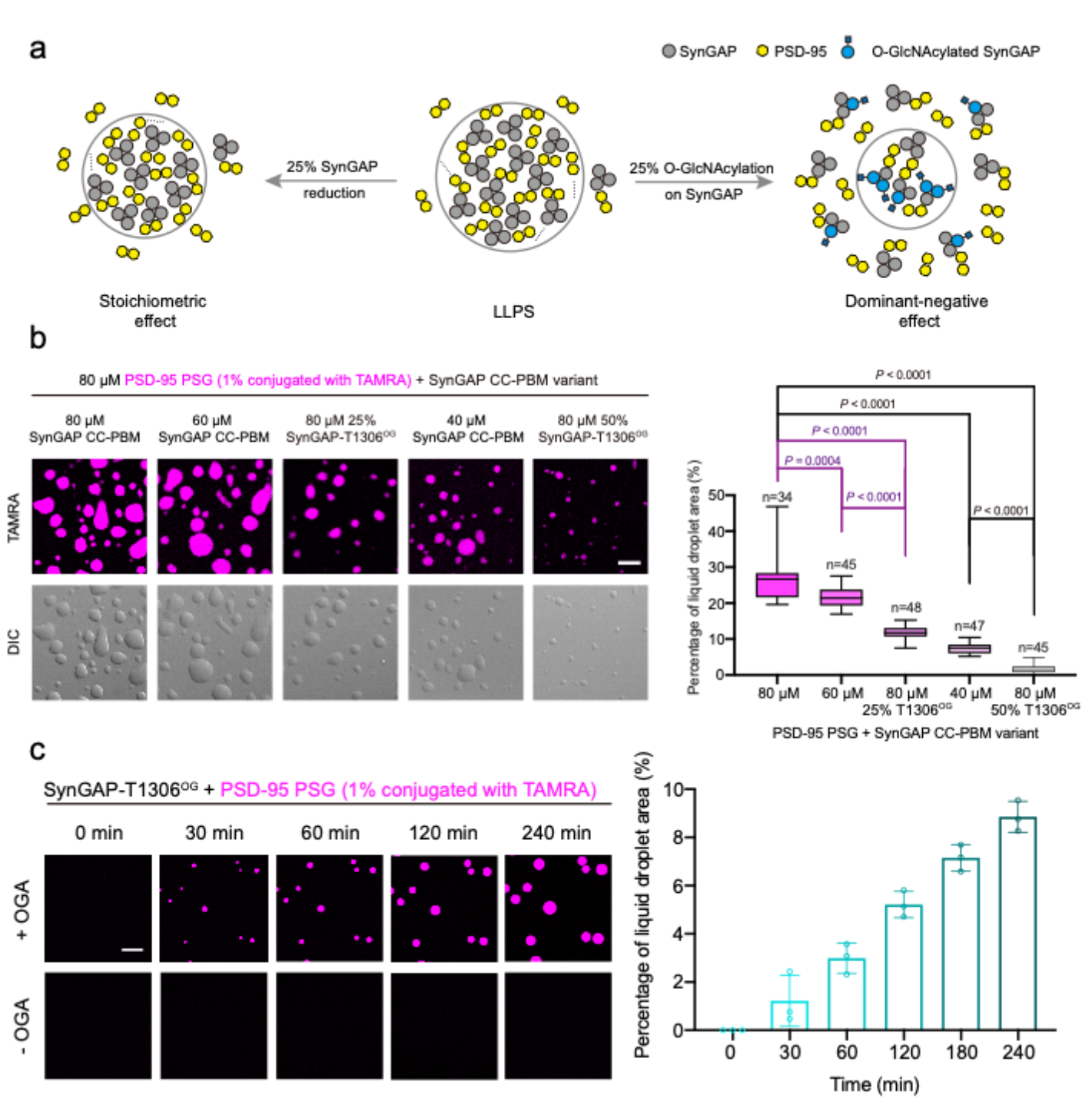
图2. O-GlcNAc修饰对LLPS的显性负调控与OGA动态调控
陈兴和董甦伟为本论文的共同通讯作者,北大-清华生命科学联合中心已毕业博士生吕品欧、杜逸飞和北京大学药学院已毕业博士生贺长栋为论文的共同第一作者。张明杰课题组、北京大学生命科学学院李沉简教授和化学与分子工程学院邹鹏课题组参与了该研究工作。该研究工作得到了国家自然科学基金委、科技部、北大-清华生命科学联合中心和北京分子科学国家研究中心的资助。
参考文献:
1. Shin, Y. & Brangwynne, C. P. Liquid phase condensation in cell physiology and disease. Science 357, eaaf4382 (2017).
2. Banani, S. F., Lee, H. O., Hyman, A. A. & Rosen, M. K. Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol.18, 285–298 (2017).
3. Chen, X., Wu, X., Wu, H. & Zhang, M. Phase separation at the synapse. Nat. Neurosci.23, 301–310 (2020).
4. Sabari, B. R. et al. Coactivator condensation at super-enhancers links phase separation and gene control. Science 361, eaar3958-17 (2018).
5. Molliex, A. et al. Phase Separation by Low Complexity Domains Promotes Stress Granule Assembly and Drives Pathological Fibrillization. Cell 163, 123–133 (2015).
6. Du, M. & Chen, Z. J. DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361, 704–709 (2018).
7. Ambadipudi, S., Biernat, J., Riedel, D., Mandelkow, E. & Zweckstetter, M. Liquid–liquid phase separation of the microtubule-binding repeats of the Alzheimer-related protein Tau. Nat. Commun.8, 275 (2017).
8. Hofweber, M. & Dormann, D. Friend or foe-Post-translational modifications as regulators of phase separation and RNP granule dynamics. J. Biol. Chem.294, 7137–7150 (2019).
9. Nott, T. J. et al. Phase Transition of a Disordered Nuage Protein Generates Environmentally Responsive Membraneless Organelles. Mol. Cell 57, 936–947 (2015).
10. Qamar, S. et al. FUS Phase Separation Is Modulated by a Molecular Chaperone and Methylation of Arginine Cation-π Interactions. Cell 173, 720-734.e15 (2018).
11. Hofweber, M. et al. Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation. Cell 173, 706-719.e13 (2018).
12. Ryan, V. H. et al. Mechanistic View of hnRNPA2 Low-Complexity Domain Structure, Interactions, and Phase Separation Altered by Mutation and Arginine Methylation. Mol. Cell 69, 465-479.e7 (2018).
13. Tsang, B. et al. Phosphoregulated FMRP phase separation models activity-dependent translation through bidirectional control of mRNA granule formation. Proc. Natl. Acad. Sci. U.S.A.116, 4218–4227 (2019).
14. Kim, T. H. et al. Phospho-dependent phase separation of FMRP and CAPRIN1 recapitulates regulation of translation and deadenylation. Science 365, 825–829 (2019).
15. Murray, D. T. et al. Structure of FUS Protein Fibrils and Its Relevance to Self-Assembly and Phase Separation of Low-Complexity Domains. Cell 171, 615-627.e16 (2017).
16. Wang, A. et al. A single N‐terminal phosphomimic disrupts TDP‐43 polymerization, phase separation, and RNA splicing. Embo J 37, e97452 (2018).
17. Lagerlof, O. & Hart, G. W. O-GlcNAcylation of Neuronal Proteins: Roles in Neuronal Functions and in Neurodegeneration. in Glycobiology of the Nervous System vol. 9 343–366 (Glycobiology of the Nervous System, 2014).
18. Lagerlof, O., Hart, G. W. & Huganir, R. L. O-GlcNAc transferase regulates excitatory synapse maturity. Proc. Natl. Acad. Sci. U.S.A.114, 1684–1689 (2017).
19. Zeng, M. et al. Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175.e12 (2016).
20. Zeng, M. et al. Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell 174, 1172-1187.e16 (2018).
 闂傚倷娴囬褏鈧稈鏅犻、娆撳冀椤撶偟鐛ュ┑掳鍊愰崑鎾绘偂閵堝鐓熼柡鍐ㄥ亞閸庣娀鏌嶈閸撴瑩宕愰崸妞尖偓渚€寮撮姀鐘栄囨煕閳╁啨浠︾紒顔ㄥ洦鈷戦悹鍥皺缁犳娊鏌涚€n剙鈻堢€规洘鍨块獮鍥偋閸繀鐢婚柣鐔哥矌婢ф鏁Δ鍛惞闁稿本绮庣壕濂告煕濞嗗浚妲归悘蹇ョ畵閺岀喖鎼归锝囶槰缂備礁鍊圭敮鐐哄焵椤掑﹦绉甸柛瀣閳绘捁绠涢幘顖涙杸濡炪倖姊婚悡顐︻敂閸曨厽娈惧銈嗗笂濡炴帞鎹㈤崱娑欑參婵☆垳灏ㄧ槐姘舵煛閸愩劎澧涢柛搴$灱缁辨帞鈧綆鍋掗崕銉︾箾瀹割喖骞楃紒缁樼箞婵偓闁挎繂瀛╃紞鍫ユ煟閵忊晛鐏i柛瀣枎鍗遍柟鐗堟緲缁犳娊鏌熼崘鑼紞闁哥姵鐗犻悰顕€骞囬鐔峰妳闂佹寧绻傚Λ顓㈠触閸ャ劎绡€闁汇垽娼ф禒婊勩亜閺囥劌骞楅柛鎺戯功閳ь剟娼ч幗婊呯矆婵犲洦鐓冪憸婊堝礈閻斿娼栧┑鐘宠壘缁€鍐┿亜閹捐泛鏋旈柕鍡楋功缁辨挻鎷呮禒瀣懙闁汇埄鍨埀顒€纾弳锕傛煟閺冨倵鎷¢柡浣稿暞閵囧嫰骞囬埡浣轰患闂傚⿵绠撳濠氬磼濞嗘劗銈板┑鈩冦仠閸旀垿骞婂Δ鍛濞达絿鎳撴惔濠傗攽閻樼粯娑ч柣妤€绻掔划鍫熺節閸ャ劌鈧敻鏌ㄥ┑鍡涱€楀褜鍨堕弻娑㈡偐閸欏妫﹂梺鍝勮閸斿矂鍩為幋锕€骞㈡俊顖滃劋椤忕娀姊绘担鍛婃儓妞ゆ垵鍊垮畷鎴﹀箻缂佹ǚ鎷绘繛杈剧到閹诧繝骞嗛崼銉︾厱濠电姳鑳堕惌娆撴煥濠靛牆浠︾€垫澘瀚伴獮鍥煘閹傚婵炴挻鍩冮崑鎾绘煛娴h宕岄柡浣规崌閺佹捇鏁撻敓锟�>>
闂傚倷娴囬褏鈧稈鏅犻、娆撳冀椤撶偟鐛ュ┑掳鍊愰崑鎾绘偂閵堝鐓熼柡鍐ㄥ亞閸庣娀鏌嶈閸撴瑩宕愰崸妞尖偓渚€寮撮姀鐘栄囨煕閳╁啨浠︾紒顔ㄥ洦鈷戦悹鍥皺缁犳娊鏌涚€n剙鈻堢€规洘鍨块獮鍥偋閸繀鐢婚柣鐔哥矌婢ф鏁Δ鍛惞闁稿本绮庣壕濂告煕濞嗗浚妲归悘蹇ョ畵閺岀喖鎼归锝囶槰缂備礁鍊圭敮鐐哄焵椤掑﹦绉甸柛瀣閳绘捁绠涢幘顖涙杸濡炪倖姊婚悡顐︻敂閸曨厽娈惧銈嗗笂濡炴帞鎹㈤崱娑欑參婵☆垳灏ㄧ槐姘舵煛閸愩劎澧涢柛搴$灱缁辨帞鈧綆鍋掗崕銉︾箾瀹割喖骞楃紒缁樼箞婵偓闁挎繂瀛╃紞鍫ユ煟閵忊晛鐏i柛瀣枎鍗遍柟鐗堟緲缁犳娊鏌熼崘鑼紞闁哥姵鐗犻悰顕€骞囬鐔峰妳闂佹寧绻傚Λ顓㈠触閸ャ劎绡€闁汇垽娼ф禒婊勩亜閺囥劌骞楅柛鎺戯功閳ь剟娼ч幗婊呯矆婵犲洦鐓冪憸婊堝礈閻斿娼栧┑鐘宠壘缁€鍐┿亜閹捐泛鏋旈柕鍡楋功缁辨挻鎷呮禒瀣懙闁汇埄鍨埀顒€纾弳锕傛煟閺冨倵鎷¢柡浣稿暞閵囧嫰骞囬埡浣轰患闂傚⿵绠撳濠氬磼濞嗘劗銈板┑鈩冦仠閸旀垿骞婂Δ鍛濞达絿鎳撴惔濠傗攽閻樼粯娑ч柣妤€绻掔划鍫熺節閸ャ劌鈧敻鏌ㄥ┑鍡涱€楀褜鍨堕弻娑㈡偐閸欏妫﹂梺鍝勮閸斿矂鍩為幋锕€骞㈡俊顖滃劋椤忕娀姊绘担鍛婃儓妞ゆ垵鍊垮畷鎴﹀箻缂佹ǚ鎷绘繛杈剧到閹诧繝骞嗛崼銉︾厱濠电姳鑳堕惌娆撴煥濠靛牆浠︾€垫澘瀚伴獮鍥煘閹傚婵炴挻鍩冮崑鎾绘煛娴h宕岄柡浣规崌閺佹捇鏁撻敓锟�>>  闂傚倸鍊搁崐椋庢濮橆兗缂氱憸宥堢亱濠德板€曢幊蹇涘吹閹邦厹浜滈柡宥庡亜娴犳粌顩奸崨瀛樷拺闁硅偐鍋涢崝妤呮煛閸涱喚鎳囬柟顔惧仦缁绘繈宕堕埡浣哥导闂備焦鎮堕崕顖炲礉鎼淬劌违闁圭儤顨嗛悡鐔兼煙闁箑澧鹃柛鏃傚枔缁辨帗娼忛妸銉ь儌闂佺懓鍢查澶愬箹瑜版帩鏁冮柕鍫濆暙娴犳帡姊婚崒娆掑厡閺嬵亝銇勯幋婵囶棤缂侇喗鐟╅獮鎺楀籍閸屾粎鍘┑鐘灱濞夋盯顢栭崱娑樼?闁绘柨鍚嬮悡鍐煏婢跺牆鍔氱紒鐙欏嫪绻嗘い鏍ㄧ啲闊剟鏌″畝鈧崰鏍х暦濡ゅ懎绀傞柣鎾抽閺€顓熶繆閻愵亜鈧垿宕曢弻銉ョ闁搞儺鍏欓埀顑跨椤粓鍩€椤掑嫮宓侀柡宥冨妽婵挳鏌i悢纰辨殥闁告繃顨婂缁樻媴閾忓箍鈧﹪鏌涢幘瀵哥疄鐎规洘绻嗙粻娑樷槈濡》绱遍梻浣告贡閸嬫捇宕滃璺鸿Е閻庯綆鍠楅悡鏇㈡煃閳轰礁鏋ゆ繛鍫熒戞穱濠囶敍濮橆剦浼冮梺鍝勭焿缁查箖骞嗛弮鍫澪╅柨鏂剧矙閺侇亪姊绘担鍛婂暈闁煎綊绠栭、鏍ㄥ緞閹邦喖绁﹂梺纭呮彧闂勫嫰寮查幓鎺濈唵閻犺櫣灏ㄩ崝鐔搞亜閺傛寧鍤囨慨濠冩そ濡啫鈽夋潏銊㈡灁闂備焦鎮堕崝宀€澹曢鐘插灊闁割偆鍠庣欢鐐烘煙闁箑骞橀柛妯圭矙濮婇缚銇愰幒鎴滃枈闂佸摜濮甸〃濠傜暦閻㈢ǹ鐒垫い鎺戝閳锋垿鏌熼懖鈺佷粶闁逞屽厵閸婃繂鐣烽幎鑺ユ櫜闁告侗鍨卞▓楣冩⒑鐠恒劌鏋斿┑顔碱嚟缁牓宕橀鐣屽幍缂傚倷鐒﹂敋缂佹せ鏅滈妵鍕棘濞嗙偓鈻堝┑顔硷龚濞咃絿鍒掑▎鎴炲磯闁靛ě灞芥暪缂傚倸鍊风粈渚€藝闁秴绀傛俊顖濇閺嗭妇鎲搁悧鍫濈瑨缁炬儳鍚嬬换娑㈠箣濠靛牞绱為梺娲诲幗椤ㄥ﹤顫忛搹鐟板闁哄洨鍋涢埛澶婎渻閵堝啫濡奸柟铏姇椤曘儲绻濋崶褔鏁滃┑掳鍊撻懗鍫曞储娴犲鈷戦梻鍫熺〒缁犵偤鏌涙繝鍐ⅹ闁宠棄顦抽ˇ褰掓煛瀹€瀣М闁糕晛瀚板畷姗€顢旈崨顓熺彴闂傚倷娴囬鏍疮椤愶箑鐐婄憸鏃堝船閸洘鈷戠紓浣股戦ˉ鍫熴亜閵夛附灏扮紒鍌涘浮楠炲洭鎮ч崼銏犲箺闂佺鍋愮悰銉╁礈濠靛牊瀚婚柨鐔哄У閻撴洟鎮楅敐搴♀偓璺ㄧ磽濮樿京纾奸弶鍫氭櫅娴犙囨煃瑜滈崜銊х礊閸℃稑鐒垫い鎴炲劤閻忊晝绱撳鍜冭含鐎殿喖顭锋俊姝岊槷闁稿鎹囬弫鎰償濡桨澹曞銈嗙墦閸婃牜鈧熬鎷�>>
闂傚倸鍊搁崐椋庢濮橆兗缂氱憸宥堢亱濠德板€曢幊蹇涘吹閹邦厹浜滈柡宥庡亜娴犳粌顩奸崨瀛樷拺闁硅偐鍋涢崝妤呮煛閸涱喚鎳囬柟顔惧仦缁绘繈宕堕埡浣哥导闂備焦鎮堕崕顖炲礉鎼淬劌违闁圭儤顨嗛悡鐔兼煙闁箑澧鹃柛鏃傚枔缁辨帗娼忛妸銉ь儌闂佺懓鍢查澶愬箹瑜版帩鏁冮柕鍫濆暙娴犳帡姊婚崒娆掑厡閺嬵亝銇勯幋婵囶棤缂侇喗鐟╅獮鎺楀籍閸屾粎鍘┑鐘灱濞夋盯顢栭崱娑樼?闁绘柨鍚嬮悡鍐煏婢跺牆鍔氱紒鐙欏嫪绻嗘い鏍ㄧ啲闊剟鏌″畝鈧崰鏍х暦濡ゅ懎绀傞柣鎾抽閺€顓熶繆閻愵亜鈧垿宕曢弻銉ョ闁搞儺鍏欓埀顑跨椤粓鍩€椤掑嫮宓侀柡宥冨妽婵挳鏌i悢纰辨殥闁告繃顨婂缁樻媴閾忓箍鈧﹪鏌涢幘瀵哥疄鐎规洘绻嗙粻娑樷槈濡》绱遍梻浣告贡閸嬫捇宕滃璺鸿Е閻庯綆鍠楅悡鏇㈡煃閳轰礁鏋ゆ繛鍫熒戞穱濠囶敍濮橆剦浼冮梺鍝勭焿缁查箖骞嗛弮鍫澪╅柨鏂剧矙閺侇亪姊绘担鍛婂暈闁煎綊绠栭、鏍ㄥ緞閹邦喖绁﹂梺纭呮彧闂勫嫰寮查幓鎺濈唵閻犺櫣灏ㄩ崝鐔搞亜閺傛寧鍤囨慨濠冩そ濡啫鈽夋潏銊㈡灁闂備焦鎮堕崝宀€澹曢鐘插灊闁割偆鍠庣欢鐐烘煙闁箑骞橀柛妯圭矙濮婇缚銇愰幒鎴滃枈闂佸摜濮甸〃濠傜暦閻㈢ǹ鐒垫い鎺戝閳锋垿鏌熼懖鈺佷粶闁逞屽厵閸婃繂鐣烽幎鑺ユ櫜闁告侗鍨卞▓楣冩⒑鐠恒劌鏋斿┑顔碱嚟缁牓宕橀鐣屽幍缂傚倷鐒﹂敋缂佹せ鏅滈妵鍕棘濞嗙偓鈻堝┑顔硷龚濞咃絿鍒掑▎鎴炲磯闁靛ě灞芥暪缂傚倸鍊风粈渚€藝闁秴绀傛俊顖濇閺嗭妇鎲搁悧鍫濈瑨缁炬儳鍚嬬换娑㈠箣濠靛牞绱為梺娲诲幗椤ㄥ﹤顫忛搹鐟板闁哄洨鍋涢埛澶婎渻閵堝啫濡奸柟铏姇椤曘儲绻濋崶褔鏁滃┑掳鍊撻懗鍫曞储娴犲鈷戦梻鍫熺〒缁犵偤鏌涙繝鍐ⅹ闁宠棄顦抽ˇ褰掓煛瀹€瀣М闁糕晛瀚板畷姗€顢旈崨顓熺彴闂傚倷娴囬鏍疮椤愶箑鐐婄憸鏃堝船閸洘鈷戠紓浣股戦ˉ鍫熴亜閵夛附灏扮紒鍌涘浮楠炲洭鎮ч崼銏犲箺闂佺鍋愮悰銉╁礈濠靛牊瀚婚柨鐔哄У閻撴洟鎮楅敐搴♀偓璺ㄧ磽濮樿京纾奸弶鍫氭櫅娴犙囨煃瑜滈崜銊х礊閸℃稑鐒垫い鎴炲劤閻忊晝绱撳鍜冭含鐎殿喖顭锋俊姝岊槷闁稿鎹囬弫鎰償濡桨澹曞銈嗙墦閸婃牜鈧熬鎷�>>  闂傚倸鍊搁崐宄懊归崶顒婄稏濠㈣泛饪村〒濠氭煕瑜庨〃鍛村磼閵娿儙鏃堟晲閸涱厽鐏曠紓鍌氱У閻楁鎹㈠┑瀣棃婵炴垵宕崜鎵磼缂併垹骞愰柛瀣崌濮婄粯鎷呴崨濠冨創濠电偛鐪伴崝宥夊箞閵娾晜鍊婚柤鎭掑劚閸撳綊鏌熼崗鑲╂殬闁告柨绉归幃锟犳偐绾版ê浜鹃悷娆忓缁€鈧┑鐐茬湴閸婃牜绮嬮幒妤佹櫆闁告挆鍜冪床濠电偠鎻徊浠嬪箺濠婂牆绠洪柣妯肩帛閻撴瑦銇勯弽銊р姇妞ゃ儱鐗撻弻鈩冩媴鐟欏嫬纾抽梺杞扮劍閹瑰洭寮幘缁樻櫢闁跨噦鎷�-濠电姷鏁告慨鐑藉极閹间礁纾块柟瀵稿Т缁躲倝鏌﹀Ο渚Ш闁哄棴闄勯妵鍕箳閹存繍浠奸梺娲诲幗椤ㄥ﹪寮诲☉銏犵労闁告劧绱曠槐鏉款渻閵堝倹娅嗛柣鎿勭節瀵鈽夐姀鐘靛姶闂佸憡鍔栭崕鍐残掗埀顒勬⒒娴e憡璐¢柛搴涘€濋獮鎰磼濡⒈娲搁梺闈涚墕濡稓绮绘ィ鍐╃厱闁斥晛鍙愰幋鐘辩剨妞ゅ繐鐗婇悡鍐喐濠婂牆绀堟繛鍡樺灩閻捇鏌熺紒銏犳珯缂傚秵鐗犻弻鏇$疀鐎n亖鍋撻弽顓炵柧闁哄被鍎查悡鏇熺箾閹存繂鑸归柡瀣剁畵閺屾稑顫濋悡搴濆枈濠殿喖锕ㄥ▍锝夊箖娴兼潙鐏抽柛蹇撴噹椤ユ岸姊婚崒娆愮グ鐎规洜鏁诲畷浼村箛椤掑鍞靛┑鈽嗗灥閸嬫劗绮堟繝鍌樷偓鎺戭潩閿濆懍澹曢梻浣告惈閻ジ宕伴幘璇茬劦妞ゆ帊鑳堕埊鏇㈡煥濮樿埖鐓熼煫鍥ュ劤缁嬭崵绱掔紒妯肩畺缂佺粯绻堝畷姗€濡歌濞n喗淇婇悙顏勨偓鏍洪埡鍐濞撴埃鍋撶€规洘妞介崺鈧い鎺嶉檷娴滄粓鏌熼悜妯虹仴闁逞屽墮閸㈡煡鍩㈡禒瀣垫晜闁割偆鍠撻崢鎼佹⒑閹肩偛鍔楅柡鍛洴椤㈡挾浠﹂崜褏顔曢梺鍏肩ゴ閺呮盯鍩㈤崼銉︾厵妞ゆ梻鐡斿▓鏃堟煃閽樺妯€鐎规洘锚椤斿繘顢欓挊澶嬬亷闂傚倸鍊烽懗鍓佸垝椤栫偞鍋嬮柣鎰ゴ閺嬪秹鏌ㄥ┑鍡樻悙闁搞劍绻冮幈銊ノ熼幐搴c€愮紓浣插亾闁割偅绶疯ぐ鎺撴櫜闁告侗鍠涚涵鈧梻浣告惈濡稒绻涢埀顒佹叏婵犲啯銇濋柟顔惧厴楠炲秹顢欐繝姘粣闂傚倷鑳舵灙妞ゆ垵妫濋獮鎴﹀炊椤掆偓閽冪喖鏌ㄩ悢鍝勑㈤梺鍗炴处閵囧嫰骞掑鍥舵М濡炪倕楠忛幏锟�>>
闂傚倸鍊搁崐宄懊归崶顒婄稏濠㈣泛饪村〒濠氭煕瑜庨〃鍛村磼閵娿儙鏃堟晲閸涱厽鐏曠紓鍌氱У閻楁鎹㈠┑瀣棃婵炴垵宕崜鎵磼缂併垹骞愰柛瀣崌濮婄粯鎷呴崨濠冨創濠电偛鐪伴崝宥夊箞閵娾晜鍊婚柤鎭掑劚閸撳綊鏌熼崗鑲╂殬闁告柨绉归幃锟犳偐绾版ê浜鹃悷娆忓缁€鈧┑鐐茬湴閸婃牜绮嬮幒妤佹櫆闁告挆鍜冪床濠电偠鎻徊浠嬪箺濠婂牆绠洪柣妯肩帛閻撴瑦銇勯弽銊р姇妞ゃ儱鐗撻弻鈩冩媴鐟欏嫬纾抽梺杞扮劍閹瑰洭寮幘缁樻櫢闁跨噦鎷�-濠电姷鏁告慨鐑藉极閹间礁纾块柟瀵稿Т缁躲倝鏌﹀Ο渚Ш闁哄棴闄勯妵鍕箳閹存繍浠奸梺娲诲幗椤ㄥ﹪寮诲☉銏犵労闁告劧绱曠槐鏉款渻閵堝倹娅嗛柣鎿勭節瀵鈽夐姀鐘靛姶闂佸憡鍔栭崕鍐残掗埀顒勬⒒娴e憡璐¢柛搴涘€濋獮鎰磼濡⒈娲搁梺闈涚墕濡稓绮绘ィ鍐╃厱闁斥晛鍙愰幋鐘辩剨妞ゅ繐鐗婇悡鍐喐濠婂牆绀堟繛鍡樺灩閻捇鏌熺紒銏犳珯缂傚秵鐗犻弻鏇$疀鐎n亖鍋撻弽顓炵柧闁哄被鍎查悡鏇熺箾閹存繂鑸归柡瀣剁畵閺屾稑顫濋悡搴濆枈濠殿喖锕ㄥ▍锝夊箖娴兼潙鐏抽柛蹇撴噹椤ユ岸姊婚崒娆愮グ鐎规洜鏁诲畷浼村箛椤掑鍞靛┑鈽嗗灥閸嬫劗绮堟繝鍌樷偓鎺戭潩閿濆懍澹曢梻浣告惈閻ジ宕伴幘璇茬劦妞ゆ帊鑳堕埊鏇㈡煥濮樿埖鐓熼煫鍥ュ劤缁嬭崵绱掔紒妯肩畺缂佺粯绻堝畷姗€濡歌濞n喗淇婇悙顏勨偓鏍洪埡鍐濞撴埃鍋撶€规洘妞介崺鈧い鎺嶉檷娴滄粓鏌熼悜妯虹仴闁逞屽墮閸㈡煡鍩㈡禒瀣垫晜闁割偆鍠撻崢鎼佹⒑閹肩偛鍔楅柡鍛洴椤㈡挾浠﹂崜褏顔曢梺鍏肩ゴ閺呮盯鍩㈤崼銉︾厵妞ゆ梻鐡斿▓鏃堟煃閽樺妯€鐎规洘锚椤斿繘顢欓挊澶嬬亷闂傚倸鍊烽懗鍓佸垝椤栫偞鍋嬮柣鎰ゴ閺嬪秹鏌ㄥ┑鍡樻悙闁搞劍绻冮幈銊ノ熼幐搴c€愮紓浣插亾闁割偅绶疯ぐ鎺撴櫜闁告侗鍠涚涵鈧梻浣告惈濡稒绻涢埀顒佹叏婵犲啯銇濋柟顔惧厴楠炲秹顢欐繝姘粣闂傚倷鑳舵灙妞ゆ垵妫濋獮鎴﹀炊椤掆偓閽冪喖鏌ㄩ悢鍝勑㈤梺鍗炴处閵囧嫰骞掑鍥舵М濡炪倕楠忛幏锟�>>  婵犵數濮烽弫鎼佸磻閻愬搫鍨傞柛顐f礀缁犳澘鈹戦悩宕囶暡闁稿顑嗙换婵囩節閸屾粌顣洪梺姹囧€楅崑鎾诲Φ閸曨垰绠涢柛顐f礃椤庡秵绻濆▓鍨仩闁告艾顑嗙粚杈ㄧ節閸ヮ灛褔鏌涚仦鍓х叝濠㈣娲熷缁樻媴缁涘娈愰梺鍝ュУ椤ㄥ懎宓勯梺鍝勫閻忓児mo Fisher闂傚倸鍊峰ù鍥х暦閸偅鍙忕€广儱顦粈瀣亜閹捐泛鏋庨柛銊ㄤ含缁辨捇宕掑▎鎴g獥闂侀潻缍嗛崳锝呯暦瑜版帗鐒肩€规挶鍎卞ú锔锯偓浣冨亹閳ь剚绋掗敋闁逞屽墰閸忔﹢寮婚悢灏佹灁闁割煈鍠楅悘鎾绘⒑绾懏鐝柛鏃€鐟╁濠氭晲閸垻鏉搁梺瑙勫劤婢у酣顢欐径濞炬斀妞ゆ梻銆嬪銉︺亜椤撶姴鍘撮柡浣瑰姍閹瑩宕崟顐㈡暏婵$偑鍊栭幐楣冨磻閻旂⒈鏁婇柛娑樼摠閳锋垿姊洪銈呬粶闁兼椿鍨遍弲鍓佲偓娑欙供濞堜粙鏌i幇顖氱毢缂佺姳鍗抽弻宥夋寠婢舵ɑ笑濡ゆ浜欓崡鎶藉春閳ь剚銇勯幒鎴濃偓鎼佸垂濠靛洢浜滄い蹇撳閸氭獔ld Application Scientist闂傚倸鍊搁崐椋庢濮橆兗缂氱憸宥堢亱闂佸搫鍟犻崑鎾绘煙椤栨稒鐓ラ柕鍡樺笚缁嬪﹦鑺辨稊鐚糹ng Develop缂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏂垮⒔閻瑩鏌熷▎陇顕уú顓㈠箹瑜版帩鏁冮柕鍫濆闁裤倝姊虹拠鎻掝劉缂佸甯熼幗顐g節濞堝灝鐏犳い鏇ㄥ弮閸┾偓妞ゆ巻鍋撶紒鐘茬Ч瀹曟洘娼忛埡鍌氬簥闂佸湱鍎ゅ濠氭儗閸℃鐔嗛柤鎼佹涧婵牓鏌涚€e墎绉柡灞剧洴婵$柉顦查柛妯虹摠娣囧﹦绱掗姀鐘崇彎闂佸搫鏈粙鎺楀箚閺冨牊鏅柛鏇ㄥ弾閸炴椽姊绘担鍝ョШ妞ゃ儲鎸荤换娑㈠焵椤掑嫭鐓涢悘鐐额嚙婵″潡鏌嶈閸撱劎绱為崱娑樼婵炲棗娴氶崵鏇㈡煏婵炵偓娅嗛柍閿嬪灦缁绘盯鎳犳0婵嗘暯缂備降鍔庣划顖炲Φ閸曨垰绠f繝闈涙搐閺嬬娀鎮楀▓鍨珮闁稿锕悰顔嘉熼懖鈺冿紲濠碘槅鍨靛銊х磾閺囥垺鈷掑ù锝嚽归弳閬嶆煙绾板崬浜版鐐诧攻瀵板嫰骞囬鍌︾幢闂備礁婀遍崑鎾诲礈濮橆兗缂氶柍鍝勫€舵禍婊堟煙閺夊灝顣抽柟顔煎悑缁绘繆顦查悗姘緲椤繑銈︾憗銈勬睏闂佸湱鍎ら幐濠氭煥椤撶姷纾藉ù锝呭濡插憡銇勯弴銊ュ箻闁告帗甯¢崺锟犲川椤撱垹鏁归梻浣告惈濞层劑宕戦悙鑼殼鐎广儱顦伴埛鎴犵磽娴e顏堟倶閿曗偓閻f繈鏁愰崨顔间淮閻庤娲滈崕銈咁嚗閸曨垰绠涙い鎾跺Т楠炴姊绘担绋挎毐闁圭⒈鍋婇弫鍐Χ閸涱亝鐎哄┑鐐叉閸ㄥ湱澹曟總鍛婄厵闁圭粯甯╅崕鎰版倵濮樼偓瀚�>>
婵犵數濮烽弫鎼佸磻閻愬搫鍨傞柛顐f礀缁犳澘鈹戦悩宕囶暡闁稿顑嗙换婵囩節閸屾粌顣洪梺姹囧€楅崑鎾诲Φ閸曨垰绠涢柛顐f礃椤庡秵绻濆▓鍨仩闁告艾顑嗙粚杈ㄧ節閸ヮ灛褔鏌涚仦鍓х叝濠㈣娲熷缁樻媴缁涘娈愰梺鍝ュУ椤ㄥ懎宓勯梺鍝勫閻忓児mo Fisher闂傚倸鍊峰ù鍥х暦閸偅鍙忕€广儱顦粈瀣亜閹捐泛鏋庨柛銊ㄤ含缁辨捇宕掑▎鎴g獥闂侀潻缍嗛崳锝呯暦瑜版帗鐒肩€规挶鍎卞ú锔锯偓浣冨亹閳ь剚绋掗敋闁逞屽墰閸忔﹢寮婚悢灏佹灁闁割煈鍠楅悘鎾绘⒑绾懏鐝柛鏃€鐟╁濠氭晲閸垻鏉搁梺瑙勫劤婢у酣顢欐径濞炬斀妞ゆ梻銆嬪銉︺亜椤撶姴鍘撮柡浣瑰姍閹瑩宕崟顐㈡暏婵$偑鍊栭幐楣冨磻閻旂⒈鏁婇柛娑樼摠閳锋垿姊洪銈呬粶闁兼椿鍨遍弲鍓佲偓娑欙供濞堜粙鏌i幇顖氱毢缂佺姳鍗抽弻宥夋寠婢舵ɑ笑濡ゆ浜欓崡鎶藉春閳ь剚銇勯幒鎴濃偓鎼佸垂濠靛洢浜滄い蹇撳閸氭獔ld Application Scientist闂傚倸鍊搁崐椋庢濮橆兗缂氱憸宥堢亱闂佸搫鍟犻崑鎾绘煙椤栨稒鐓ラ柕鍡樺笚缁嬪﹦鑺辨稊鐚糹ng Develop缂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏂垮⒔閻瑩鏌熷▎陇顕уú顓㈠箹瑜版帩鏁冮柕鍫濆闁裤倝姊虹拠鎻掝劉缂佸甯熼幗顐g節濞堝灝鐏犳い鏇ㄥ弮閸┾偓妞ゆ巻鍋撶紒鐘茬Ч瀹曟洘娼忛埡鍌氬簥闂佸湱鍎ゅ濠氭儗閸℃鐔嗛柤鎼佹涧婵牓鏌涚€e墎绉柡灞剧洴婵$柉顦查柛妯虹摠娣囧﹦绱掗姀鐘崇彎闂佸搫鏈粙鎺楀箚閺冨牊鏅柛鏇ㄥ弾閸炴椽姊绘担鍝ョШ妞ゃ儲鎸荤换娑㈠焵椤掑嫭鐓涢悘鐐额嚙婵″潡鏌嶈閸撱劎绱為崱娑樼婵炲棗娴氶崵鏇㈡煏婵炵偓娅嗛柍閿嬪灦缁绘盯鎳犳0婵嗘暯缂備降鍔庣划顖炲Φ閸曨垰绠f繝闈涙搐閺嬬娀鎮楀▓鍨珮闁稿锕悰顔嘉熼懖鈺冿紲濠碘槅鍨靛銊х磾閺囥垺鈷掑ù锝嚽归弳閬嶆煙绾板崬浜版鐐诧攻瀵板嫰骞囬鍌︾幢闂備礁婀遍崑鎾诲礈濮橆兗缂氶柍鍝勫€舵禍婊堟煙閺夊灝顣抽柟顔煎悑缁绘繆顦查悗姘緲椤繑銈︾憗銈勬睏闂佸湱鍎ら幐濠氭煥椤撶姷纾藉ù锝呭濡插憡銇勯弴銊ュ箻闁告帗甯¢崺锟犲川椤撱垹鏁归梻浣告惈濞层劑宕戦悙鑼殼鐎广儱顦伴埛鎴犵磽娴e顏堟倶閿曗偓閻f繈鏁愰崨顔间淮閻庤娲滈崕銈咁嚗閸曨垰绠涙い鎾跺Т楠炴姊绘担绋挎毐闁圭⒈鍋婇弫鍐Χ閸涱亝鐎哄┑鐐叉閸ㄥ湱澹曟總鍛婄厵闁圭粯甯╅崕鎰版倵濮樼偓瀚�>>  闂傚倸鍊搁崐椋庣矆娓氣偓楠炲鏁撻悩鑼槱閻熸粎澧楃敮鎺旂矆閸喓绡€闂傚牊渚楅崕娑㈡煛娴e壊鍎旈柡灞界Ч瀹曨偊宕熼鐔蜂壕閻熸瑥瀚々鏌ユ煏閸繍妲归柣鎾存礋閺屾洘寰勭€n亞浠撮柣搴㈠嚬閸撴氨绮嬪澶嬬劶鐎广儱妫岄幏娲⒑閸︻厐鐟懊归悜钘壩ラ柟鐑橆殕閻撴洟鏌eΟ鎸庣彧缂佲偓閸垻纾兼い鏃囧Г閳锋帡鏌嶈閸撴氨绮欓幒鏇熸噷濠电偛鐡ㄩ崵搴ㄥ磹濠靛钃熼柕濞炬櫆閸嬪棝鏌涚仦鍓р槈妞ゅ骏鎷�14婵犵數濮烽弫鍛婃叏娴兼潙鍨傜憸鐗堝笚閸婂爼鏌涢鐘插姎闁汇倗鍋撶换娑㈠箣濞嗗繒浠鹃梺绋款儛娴滎亪寮诲☉銏犲嵆闁靛ǹ鍎遍埛鎺戔攽閻愯尙澧㈤柡鍜佸亰閸┾偓妞ゆ巻鍋撻柛妯荤矒瀹曟垿骞樼紒妯煎帗閻熸粍绮撳畷婊堟偄閻撳海鐣烘繛鏉戝悑濞兼瑥鏁梻浣哥枃濡椼劑鎳楅崼鏇熷亗闁硅揪闄勯埛鎴︽煙缁嬫寧鎹g紒鐘虫尰缁绘稓鎷犺閻g敻鏌熼鈧粻鏍蓟閸℃鍚嬮柛鈩冪懃楠炴﹢姊绘担鍛婂暈闁荤喆鍎佃棟閺夊牃鏅濇稉宥嗘叏濡灝鐓愰柣鎾存礋閺岀喖鎮欓浣虹▏濡炪們鍎遍鍥╂閹烘挻缍囬柕濞垮劜鐠囩偤鎮楃憴鍕鐎规洦鍓熼敐鐐测攽鐎e灚鏅㈤梺閫炲苯澧柟渚垮姂瀹曟﹢顢欑憴锝嗗闂備礁婀辨灙濡ょ姵鎮傚畷浼村即閵忥紕鍘甸梺鍛婂灟閸婃牜鈧熬鎷�>>
闂傚倸鍊搁崐椋庣矆娓氣偓楠炲鏁撻悩鑼槱閻熸粎澧楃敮鎺旂矆閸喓绡€闂傚牊渚楅崕娑㈡煛娴e壊鍎旈柡灞界Ч瀹曨偊宕熼鐔蜂壕閻熸瑥瀚々鏌ユ煏閸繍妲归柣鎾存礋閺屾洘寰勭€n亞浠撮柣搴㈠嚬閸撴氨绮嬪澶嬬劶鐎广儱妫岄幏娲⒑閸︻厐鐟懊归悜钘壩ラ柟鐑橆殕閻撴洟鏌eΟ鎸庣彧缂佲偓閸垻纾兼い鏃囧Г閳锋帡鏌嶈閸撴氨绮欓幒鏇熸噷濠电偛鐡ㄩ崵搴ㄥ磹濠靛钃熼柕濞炬櫆閸嬪棝鏌涚仦鍓р槈妞ゅ骏鎷�14婵犵數濮烽弫鍛婃叏娴兼潙鍨傜憸鐗堝笚閸婂爼鏌涢鐘插姎闁汇倗鍋撶换娑㈠箣濞嗗繒浠鹃梺绋款儛娴滎亪寮诲☉銏犲嵆闁靛ǹ鍎遍埛鎺戔攽閻愯尙澧㈤柡鍜佸亰閸┾偓妞ゆ巻鍋撻柛妯荤矒瀹曟垿骞樼紒妯煎帗閻熸粍绮撳畷婊堟偄閻撳海鐣烘繛鏉戝悑濞兼瑥鏁梻浣哥枃濡椼劑鎳楅崼鏇熷亗闁硅揪闄勯埛鎴︽煙缁嬫寧鎹g紒鐘虫尰缁绘稓鎷犺閻g敻鏌熼鈧粻鏍蓟閸℃鍚嬮柛鈩冪懃楠炴﹢姊绘担鍛婂暈闁荤喆鍎佃棟閺夊牃鏅濇稉宥嗘叏濡灝鐓愰柣鎾存礋閺岀喖鎮欓浣虹▏濡炪們鍎遍鍥╂閹烘挻缍囬柕濞垮劜鐠囩偤鎮楃憴鍕鐎规洦鍓熼敐鐐测攽鐎e灚鏅㈤梺閫炲苯澧柟渚垮姂瀹曟﹢顢欑憴锝嗗闂備礁婀辨灙濡ょ姵鎮傚畷浼村即閵忥紕鍘甸梺鍛婂灟閸婃牜鈧熬鎷�>>  生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
