
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脯氨酸羟基化酶EGLN1活性调节的新机制
【字体: 大 中 小 】 时间:2022年05月26日 来源:中国科学院水生生物研究所
编辑推荐:
近期该研究以 EGLN1 prolyl hydroxylation of hypoxia-induced transcription factor HIF1α is repressed by SET7-catalyzed lysine methylation 为题在线发表于 Journal of Biological Chemistry ( Tang et al, 2022 )
脯氨酸羟基化酶EGLN1是机体最主要的氧气感受器。在有氧的条件下,EGLN1利用O2等作为辅因子羟基化修饰低氧诱导因子HIF-α,从而导致HIF-α被VHL等形成的E3泛素连接酶复合体所识别,进而被蛋白酶体快速降解;而在低氧条件下,由于氧气的缺乏,使得脯氨酸羟基化酶EGLN1的活性受到抑制,HIF-α不能发生羟基化修饰导致其泛素化降解途径被阻断,从而导致HIF-α得以积累,进入细胞核,与HIF-1β形成复合体,从而调控低氧下游基因的表达和机体的低氧胁迫响应。
EGLN1在HIF介导的低氧信号通路中发挥着至关重要的生物学功能,然而,目前对于EGLN1活性的调节及其分子机制仍不清楚。近期,中国科学院水生生物研究所肖武汉研究员团队鉴定到了EGLN1存在着赖氨酸甲基化修饰,而赖氨酸甲基转移酶SET7介导EGLN1上第297位赖氨酸残基的甲基化修饰。
该项研究表明,SET7直接结合并甲基化修饰EGLN1,抑制其羟基化酶的活性,但是并不影响EGLN1蛋白的稳定性。EGLN1第297位赖氨酸残基的甲基化修饰,抑制了EGLN1对低氧信号通路的调控,影响细胞的代谢和增殖,从而调控细胞的低氧适应。
此外,该团队早期的研究结果表明,甲基转移酶SET7还可以直接甲基化修饰低氧诱导因子HIF-α,调控其与低氧下游基因启动子的结合能力,从而调控低氧胁迫下HIF-α的转录激活活性(Liu et al,Nucleic Acids Research,2015)。由此可见,在有氧和低氧两种生理状态下,甲基转移酶SET7通过调控不同底物蛋白的甲基化修饰,实现对机体低氧应答的精确调控。进一步,该团队还发现:SET7的敲除,可以增强鱼的低氧耐受能力(查荒源等,水生生物学报,2021)。
通过这些研究工作,不仅揭示了SET7介导的赖氨酸甲基化修饰对机体低氧应答和低氧耐受的精确调控,还为耐低氧鱼类新品种的培育提供了潜在的分子靶标。
近期该研究以EGLN1 prolyl hydroxylation of hypoxia-induced transcription factor HIF1α is repressed by SET7-catalyzed lysine methylation为题在线发表于Journal of Biological Chemistry(Tang et al, 2022)。肖武汉研究员和刘兴副研究员为论文通讯作者,唐金花博士研究生为论文第一作者。该研究得到国家自然科学基金、中科院战略性先导科技专项、国家重点研发计划等项目的资助。
论文链接:https://doi.org/10.1016/j.jbc.2022.101961
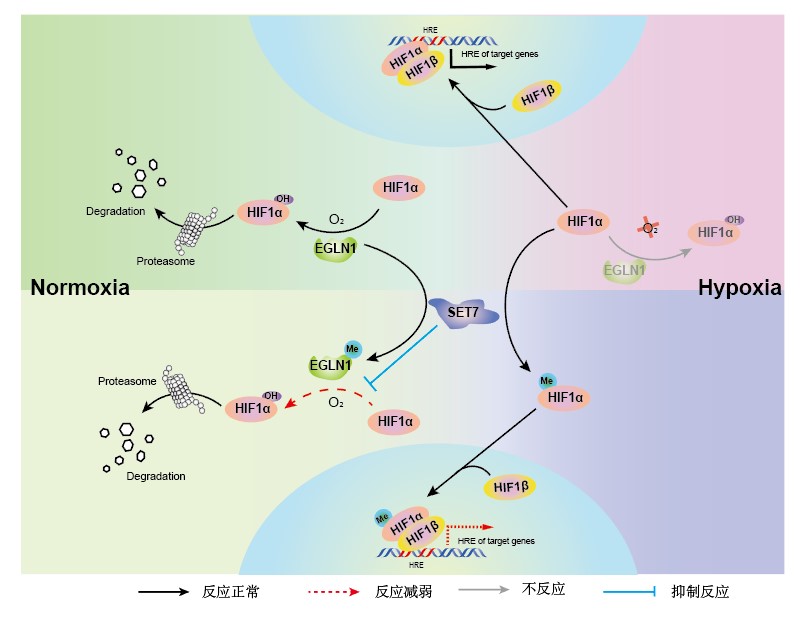
SET7介导的甲基化修饰调控低氧信号通路的作用模式
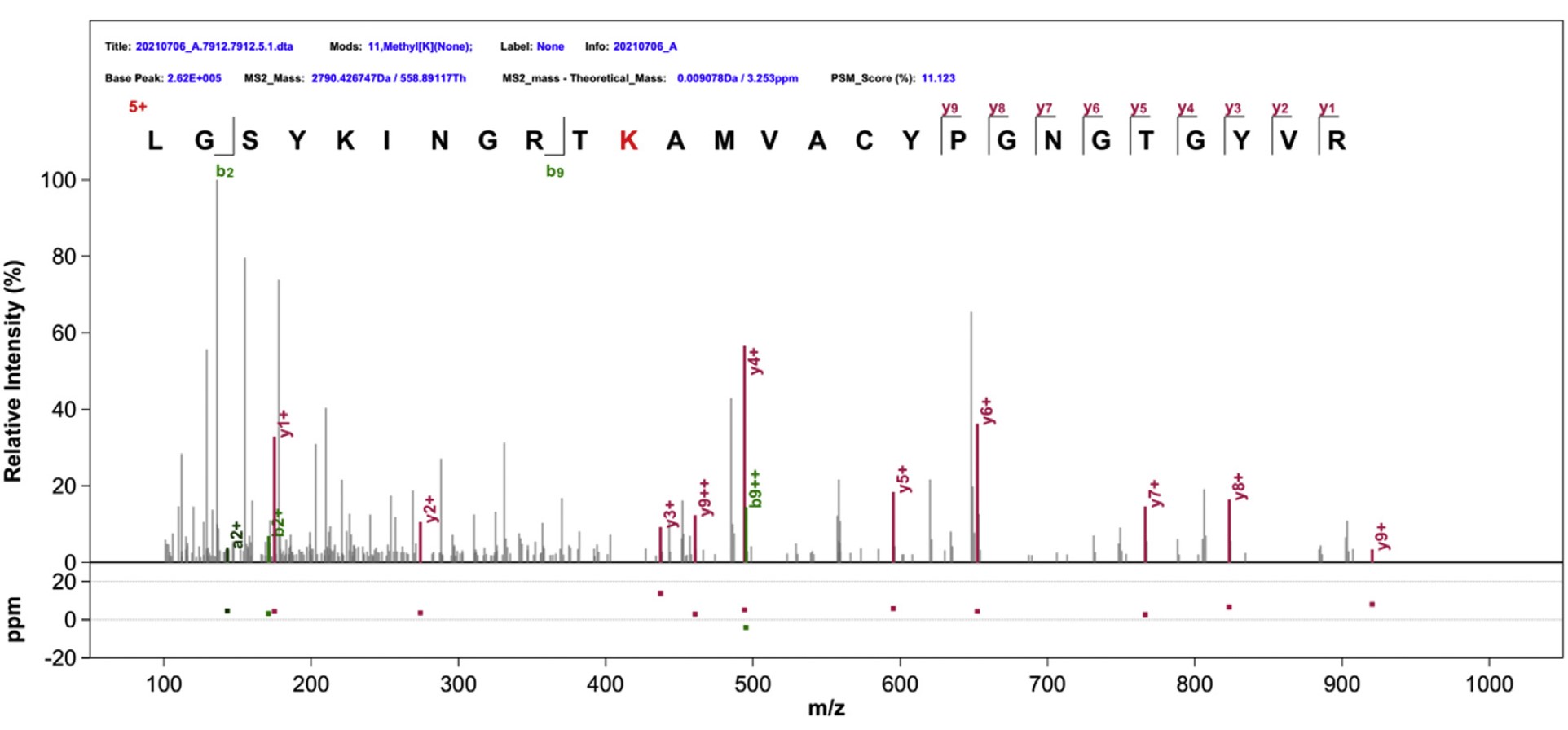
质谱鉴定EGLN1的赖氨酸甲基化修饰位点

EGLN1甲基化修饰位点的保守性
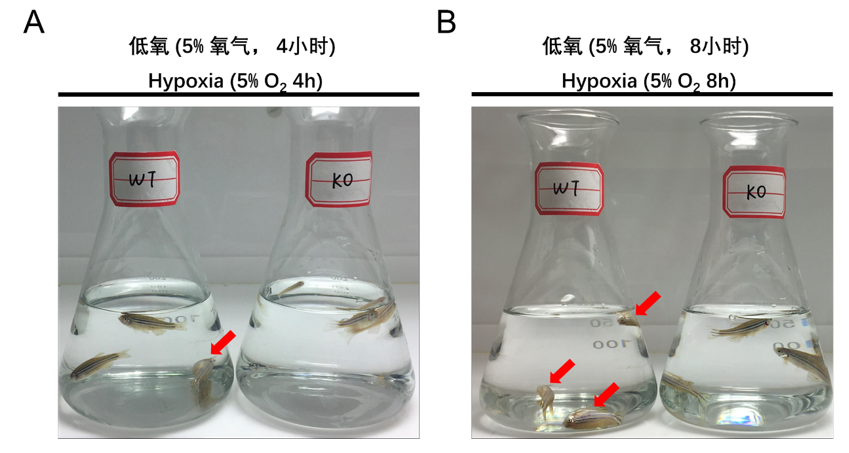
SET7的敲除增强鱼的耐低氧能力