
-

生物通官微
陪你抓住生命科技
跳动的脉搏
植物所刘建祥课题组与云南大学研究团队合作揭示UBA结构域蛋白SUF...
【字体: 大 中 小 】 时间:2022年05月13日 来源:浙江大学生命科学学院
编辑推荐:
近日, JIPB 在线发表了浙江大学生命科学学院刘建祥课题组题为 “ UBA domain protein SUF1 interacts with NatA-complex subunit NAA15 to regulate thermotolerance in Arabidopsis ” 的研究论文
全球气候变暖和极端天气影响植物多样性以及农作物的产量品质。高温胁迫会导致细胞中错误折叠蛋白质的积累,进而造成植物生长发育受阻甚至死亡。在植物高温胁迫后的恢复过程中,泛素-蛋白酶体系统(Ubiquitin-proteasome system, UPS)通过泛素化降解途径清除细胞内积累的错误折叠蛋白,促进植物存活。近年的研究表明,含有UBA(Ubiquitin-associated domain)结构域的蛋白能够保护蛋白自身或其相互作用的蛋白免受蛋白酶体的降解,参与了Ac/N端降解子途径介导的细胞内蛋白降解过程。但是,UBA结构域蛋白在植物应答高温胁迫中的功能并不清楚。
近日,JIPB在线发表了浙江大学生命科学学院刘建祥课题组题为“UBA domain protein SUF1 interacts with NatA-complex subunit NAA15 to regulate thermotolerance in Arabidopsis” 的研究论文。该研究报道了一个新的UBA结构域蛋白 SUF1(STRESS RELATED UBA-DOMAIN PROTEIN FACTOR 1)调控了拟南芥植物耐热性的功能和作用机制。
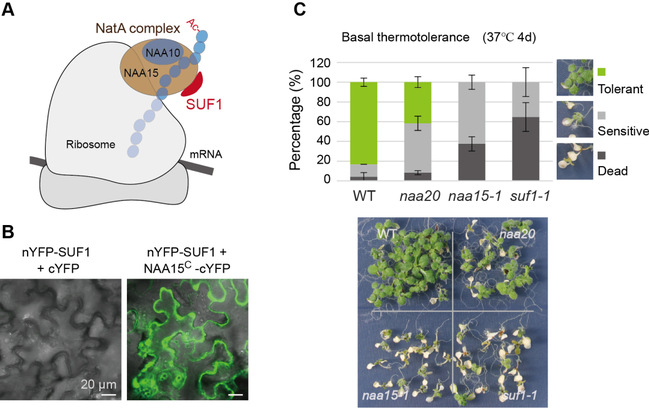
图:SUF1与NatA复合核心亚基NAA15相互作用,共同促进了拟南芥植物的耐热性:(A) SUF1是拟南芥NatA复合物的一个新组分;(B) 双分子荧光互补实验(BiFC)实验显示,SUF1与NAA15在细胞质中相互作用;(C) 拟南芥suf1突变体和naa15突变体都对持续性高温胁迫超敏感
SUF1蛋白与人类NatA复合物中HYPK(Huntingtin Yeast Partner K)高度同源。NatA复合物是植物Ac/N端规则通路(主要包括蛋白N端乙酰化、泛素化和被蛋白酶体降解,三个连续的过程)最主要的蛋白N端乙酰化转移酶,负责了大多数蛋白N端乙酰化修饰的催化反应。Ac/N端规则通路, 是真核生物中UPS降解途径的一部分,主要靶向N端乙酰化修饰的底物蛋白。遗传分析表明,SUF1是拟南芥基础耐热性的重要调控因子。蛋白-蛋白相互作用实验证明,SUF1蛋白与拟南芥NatA复合核心亚基NAA15直接相互作用。与WT植物中相比,NAA15蛋白在suf1突变体植物中更加不稳定,表明与SUF1蛋白的相互作用促进了NAA15的蛋白稳定性。此外,拟南芥naa15突变体与suf1突变体一样都有基础耐热性降低的表型。进一步分析表明,suf1突变体高温胁迫恢复阶段总蛋白泛素化程度降低,NatA复合物的已知底物SNC1蛋白更加稳定。总之,本研究发现SUF1是拟南芥NatA复合物的一个新组分,高温胁迫后恢复的过程中该蛋白通过与NAA15互作增加了NatA复合物核心亚基NAA15的稳定性,进而通过Ac/N端规则通路降解错误折叠蛋白,促进了植物的基础耐热性。
浙江大学生命科学学院刘建祥课题组已出站博士后宋泽婷(现为云南大学副研究员)为论文的第一作者。云南大学硕士研究生陈小洁和罗玲以及中国农业大学于菲菲教授参与了该项研究工作。浙江大学生命科学学院刘建祥教授和云南大学生态与环境学院韩佳嘉副研究员为论文通讯作者。该研究得到了国家自然科学基金,浙江省人才项目,云南省人才项目,云南省植物繁殖适应与进化生态学重点实验室等项目资助,是浙江大学-云南大学部省合建工作的重要合作成果之一。
论文链接:htt?ps://doi.or?g/10.1111/jipb.13273