
-

生物通官微
陪你抓住生命科技
跳动的脉搏
饶毅实验室的生物化学研究:分离纯化揭示AMPK及其相关激酶的蛋白激酶
【字体: 大 中 小 】 时间:2022年04月29日 来源:北京大学
编辑推荐:
2022年4月10日,美国生物化学和分子生物学会主办的《生物化学杂志》,在线发表了两篇饶实验室的生物化学文章,其内容完全是生物化学。
生物化学,既有自己的学术问题,也是一种研究途径。通过生物化学的分离纯化,发现分子间的相互生物化学关系,是生物学研究的最重要途径之一。
以往,饶毅实验室长期以遗传学、分子生物学研究神经生物学和发育生物学问题。
自2011年以来,实验室集中一部分精力和研究人员在实验室内建立了生物化学分离纯化方法。
起点是用于神经生物学的问题,但可能涉及其他生物学问题。
2022年4月10日,美国生物化学和分子生物学会主办的《生物化学杂志》,在线发表了两篇饶实验室的生物化学文章,其内容完全是生物化学。
这些工作的起源在于神经生物学。2016年,日本筑波的柳泽正史(Masashi Yanagisawa)发表一篇文章,他们通过小鼠的遗传筛选,找到一个影响睡眠的基因,它编码SIK3蛋白激酶。他们发现SIK3功能提高后,睡眠增加。他们发现SIK3的一个氨基酸位点(S556)被常见蛋白激酶PKA所磷酸化,S556被磷酸化后,SIK3功能被抑制。
饶毅实验室的研究生李扬和刘玉祥等发现,SIK3的另一位点(T221)有重要功能:它的磷酸化提高SIK3的功能(李扬等,投稿中)。
SIK3属于AMPK家族。AMPK家族目前被一般认为有14个成员。AMPK参与重要的生物学过程,包括代谢调控等。
2003年和2004年,四个实验室发表5篇文章,认为AMPK的上游激酶是LKB1,后者此前被发现参与抑制多种肿瘤。
饶毅实验室的刘玉祥等发现,LKB1确实能够磷酸化AMPK的特定位点(T172),无论是哺乳动物中表达后拉下来的LKB1、还是细菌表达的LKB1都能磷酸化AMPK的T172。但是,只有哺乳动物中表达后拉下来的LKB1可以磷酸化SIK3的T221,而细菌表达的LKB1不能磷酸化SIK3的T221。
饶毅实验室的刘子怡等在果蝇和小鼠制造LKB1的基因的突变,发现LKB1表达量减少后,果蝇和老鼠的睡眠都减少,说明LKB1促进睡眠(刘子怡等,投稿中)。
用哺乳动物体外培养细胞(人的HEK细胞)和小鼠脑,刘玉祥进行柱层析后发现,除了LKB1,还有其他磷酸化SIK3和AMPK的活性。
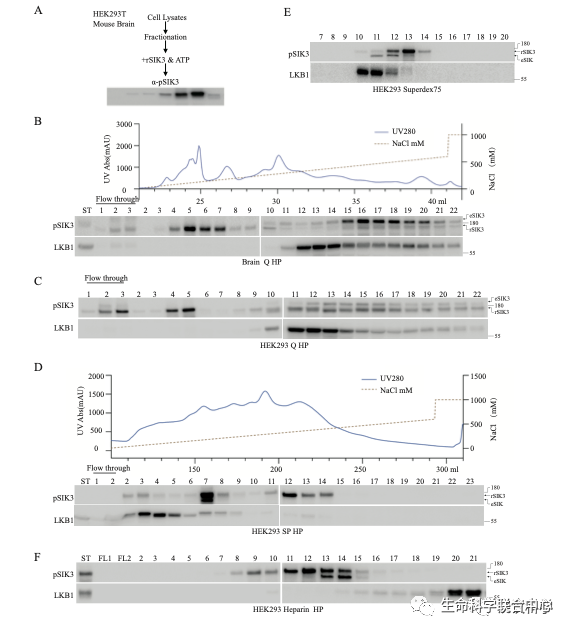
他带领崔云凤等,用50升的悬浮培养HEK细胞,用了六种色谱柱,成功地分离到了有活性的组分。
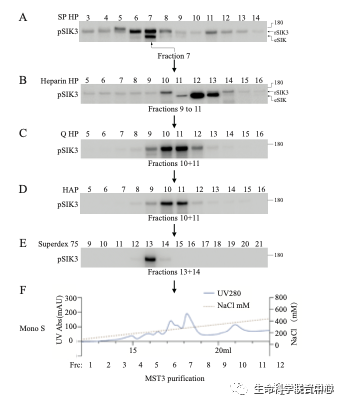
进一步的蛋白质质谱分析显示,其中有六个激酶。当这六个激酶被分别用基因表达后,只有MST3和MST4能够磷酸化SIK3-T221位点,而其他四个不能。
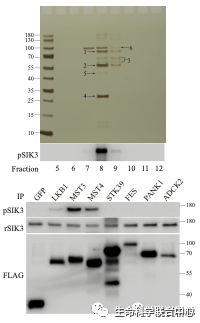
MST3不仅能够磷酸化SIK3-T221位点,而且能够提高SIK3本身的蛋白激酶活性(作用于其下游的HDAC4)。刘玉祥、王涛等附带显示,裴钢实验室发现的小鼠MST3b也与大家常见的MST3一样,有类似的对SIK3 T221的活性。MST有五个成员(1-5),SIK有三个成员(1-3)。刘玉祥等发现,MST的所有五个成员能够磷酸化SIK的所有三个成员。他们通过细菌表达的五个MST也都能够磷酸化AMPK的T172。
刘玉祥(研究生/博士后)、王涛(研究生)、崔云凤(技术员)、高胜贤(博士后)、饶毅等从而得到体外生物化学证据,提示五个MST是SIK和AMPK的蛋白激酶。
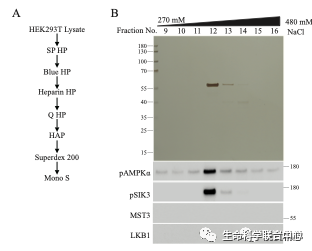
饶毅实验室基因敲除小鼠的MST3之后,发现鼠脑还有磷酸化AMPK-T172和SIK3-T221的活性。刘玉祥敲除HEK细胞的MST3之后,还有不是LKB1的活性磷酸化AMPK-T172和SIK3-T221。
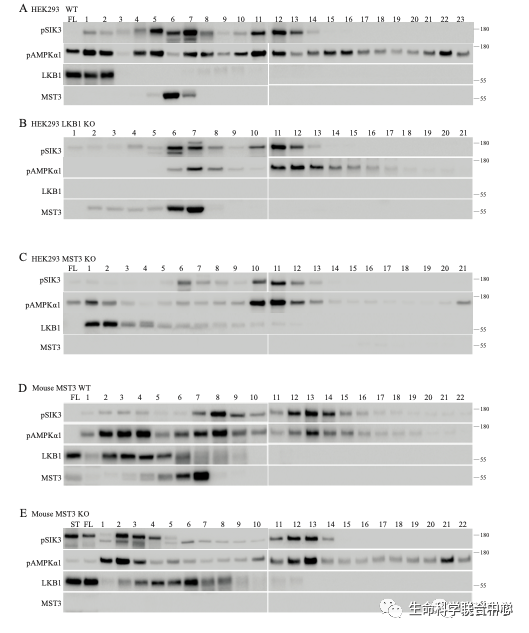
刘玉祥再次进行蛋白质分离纯化,发现CaMKK1和2。这两个激酶以前被人发现确实可以磷酸化AMPK-T172,只是没有LKB1那么引人瞩目。
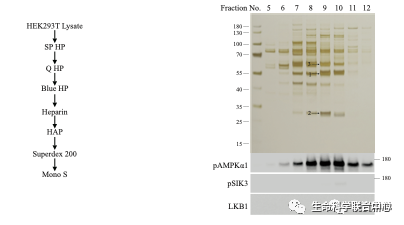
刘玉祥发现,除外CaMKK,在HEK里面还有活性可以磷酸化AMPK-T172和SIK3-T221。刘玉祥等第三次分离纯化,发现MAP4K5可以磷酸化AMPK-T172和SIK3-T221。
MST3和MAP4K5,无论是细菌表达的还是哺乳动物细胞表达的,都能够磷酸化现在通行已知的14个AMPK相关激酶。其中有些有磷酸化抗体,有些用蛋白质质谱鉴定磷酸化。
而MAP4K5与MST同属于哺乳类中类似酵母sterile 20蛋白激酶的一个亚家族。STE20亚家族有28个成员。刘玉祥、王涛、崔云凤等把28个蛋白激酶全部用细菌和HEK表达。发现其中十几到二十几个能够磷酸化AMPK和SIK3。这些激酶对于两个底物AMPK和SIK3的作用不尽相同,而不同的STE20激酶的作用也不尽相同。
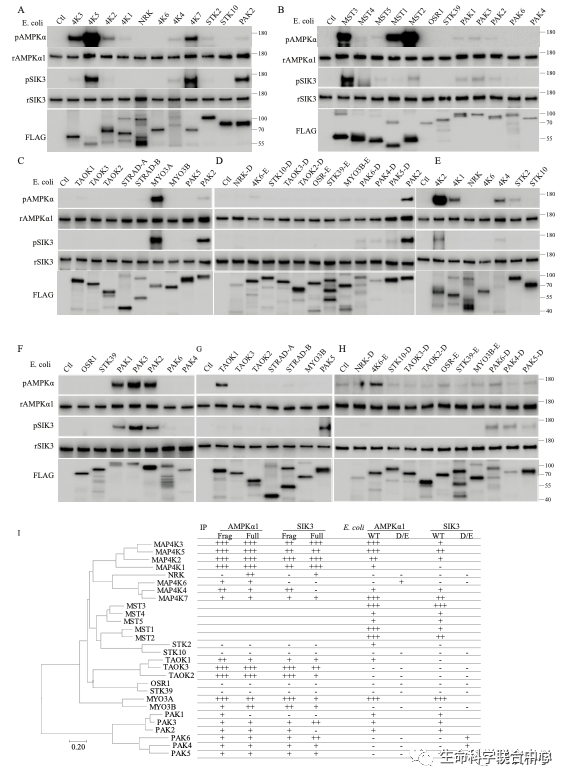
自2016年以来,刘玉祥(研究生/博士后)、王涛(研究生)、崔云凤(技术员)、李超逸(博士后)、姜丽芬(博士后)、饶毅通过体外的生物化学提示,十几二十个STE20蛋白激酶对AMPK和SIK3有磷酸化作用。
这两篇文章的强处在于:通过少见的三轮生物化学分离纯化,发现重要的蛋白激酶AMPK及其类似激酶,可以被STE20家族的多个成员所磷酸化。
这两篇文章的弱点在于:尚不清楚这些体外生物化学发现的体内生理学意义。例如,不清楚STE20对AMPK的磷酸化是否调节代谢。也不清楚STE20的家族成员能否调节睡眠。
如果STE20-AMPK上下游关系确实参与很多、很重要的生理学过程,这些发现就是重要的突破性发现。
如果STE20-AMPK上下游关系在体内不参与重要生理学过程,这些发现就是体外的优美的生物化学,但类似水中的月,除了观赏,没有什么用处。
Liu YX, Wang TV, Cui YF, Gao SX and Rao Y (2022). Biochemical purification uncovers mammalian sterile 3 (MST3) as a new protein kinase for multifunctional protein kinases AMPK and SIK3. J Biol Chem 2022.101929.
Liu YX, Wang TV, Cui YF, Li CY, Jiang LF and Rao Y (2022). STE20 phosphorylation of AMPK related kinases revealed by biochemical purifications combined with genetics. J Biol Chem 2022.101928.