
-

生物通官微
陪你抓住生命科技
跳动的脉搏
未来技术学院何爱彬研究组揭示造血干细胞起源的表观遗传层级调控
【字体: 大 中 小 】 时间:2022年02月05日 来源:北京大学新闻网
编辑推荐:
近日,北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心何爱彬研究组在Nature Communications杂志在线发表研究论文,从跨尺度的染色质三维结构、组蛋白修饰及造血相关转录因子RUNX1的表观调控维度,揭示了HSC起源的命运决定机制。
造血干细胞(hematopoietic stem cell, HSC)维持整个造血系统的细胞群体组成与功能。内皮-造血转化(endothelial-to-hematopoietic transition, EHT)是HSC重要的起源过程:在背主动脉的腹侧,部分早期动脉内皮细胞(early arterial endothelial cell, eAEC)特化为生血内皮细胞(hemogenic endothelial cells, HEC),产生造血干细胞前体(pre-HSC),进而成熟发育为长期造血干细胞(long-term hematopoietic stem cell, LT-HSC)。虽然单细胞转录组分析及功能实验验证剖析了从eAEC向HSC发育的动态轨迹上的不同细胞群体1, 2,但是,HSC谱系起源和命运决定是如何受到包括染色质三维结构、组蛋白修饰及转录因子的多维表观机制整合调控的,则尚未可知。
2022年1月17日,北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心何爱彬研究组在Nature Communications杂志在线发表研究论文“Pre-configuring chromatin architecture with histone modifications guides hematopoietic stem cell formation in mouse embryos”,从跨尺度的染色质三维结构、组蛋白修饰及造血相关转录因子RUNX1的表观调控维度,揭示了HSC起源的命运决定机制。
为了探究哺乳动物胚胎中多维表观遗传层级如何调控HSC发生这一科学问题,该研究突破了少量细胞检测的技术瓶颈,应用少量细胞sisHi-C(small-scale in situ Hi-C)技术3和何爱彬团队于2019年开发的少量细胞itChIP-seq(indexing and tagmentation-based chromatin immunoprecipitation sequencing)技术4,分别在数百个细胞中,检测染色质互作结构、组蛋白修饰及转录因子结合图谱。作者从小鼠胚胎的主动脉-性腺-中肾区和胎肝中分别收集了HSC发育路径上相邻的四种细胞类型:eAEC、HEC、pre-HSC以及LT-HSC(图1)。结合团队近期发表的单细胞转录组数据1, 2,以大范围到小范围的不同层级染色质空间结构发育变化为主线,进行HSC起源的多维表观遗传调控机制解析。

图1.细胞样品示意图及多维表观调控检测
促进造血发生的染色质互作变化发生在拓扑结构域(topologically associated domain, TAD)内部。在大尺度的染色质区室层级(100 Mbp),基因组被划分为转录活跃性高的A类区室和转录活跃性低的B类区室。仅有约10.78%的基因组区域存在任两个时期之间的A/B类区室互换的现象。TAD为染色质区室的下一级结构,其边界富集了H3K4me3信号,存在阻隔强度的动态变化,但并未直接影响TAD边界附近基因的表达。而进一步探究发现,TAD内部的调控元件互作及伴随的组蛋白修饰变化,直接与造血发育进程相关。
HSC特异的增强子在eAEC中已经处于一定程度的激活状态。与以往的从无到有的增强子激活认知不同的是,在EHT初期的eAEC中,造血过程相关TAD中的增强子已经显著富集激活性组蛋白修饰(H3K27ac和H3K4me1)。从eAEC经过HEC,到pre-HSC,增强子的活性信号并没有变化,仅在pre-HSC至LT-HSC这一阶段才进一步增强。这提示在eAEC中,已经初步准备好了造血发生的相关染色质修饰基础,但需要染色质互作结构及转录因子的结合,驱动促进HSC产生(图2)。
染色质互作在早期变化最显著。EHT初期(eAEC-HEC),TAD内部染色质互作大幅度变化,造血相关基因所在区域的互作显著增强。在EHT末期pre-HSC到LT-HSC转变中,TAD内互作只是小幅度增强,但标记活性增强子的组蛋白修饰H3K27ac则一定程度显著提升。整个过程中,相应的抑制性组蛋白修饰H3K27me3逐步减弱,为造血发生创造活跃染色质环境(图2)。
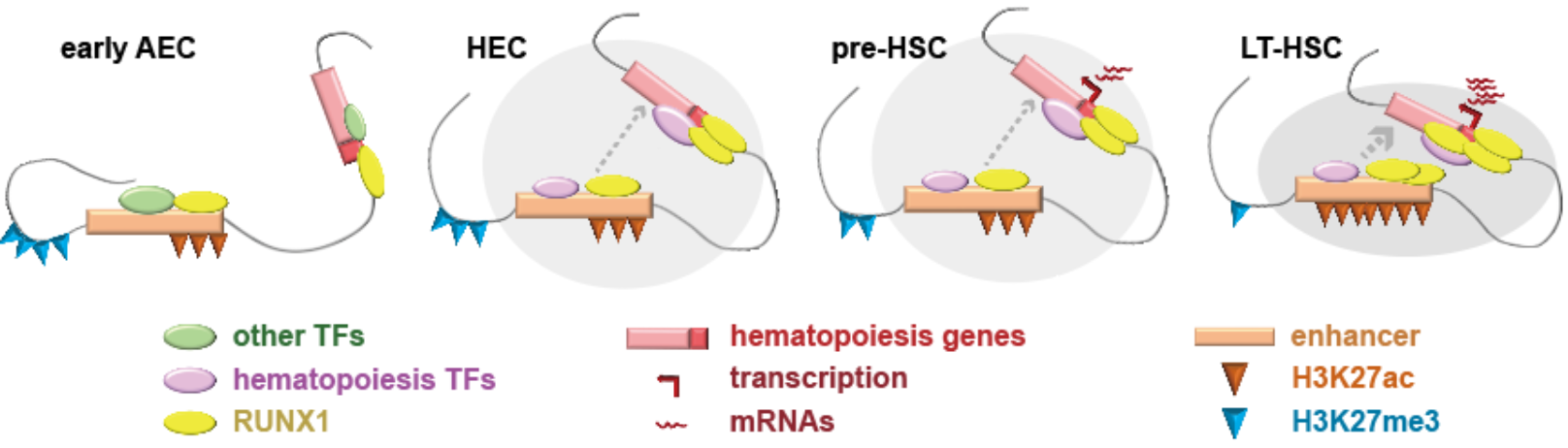
图2.HSC发生的多维表观遗传层级调控示意图
令人意外的是发现早在eAEC时期,RUNX1蛋白已富集结合于增强子-启动子(E-P)互作的锚点区域。RUNX1 是一个重要造血发育相关转录因子5,一般认为它为驱动HSC的发生所必须,其表达时间与HSC一致,它的缺失会造成胚胎造血异常或致死6, 7。受限于检测技术对细胞数目的要求,很多已有研究只能使用体外分化样品或细胞系进行RUNX1的ChIP-seq实验8, 9, 10,以探究RUNX1如何调控HSC细胞命运。利用新开发的高灵敏度itChIP-seq技术,该研究以100-500个分选细胞为起始样品,检测了eAEC、HEC、pre-HSC和LT-HSC的RUNX1全基因组结合图谱。研究发现,HSC发生过程中,RUNX1参与了约40.9%的E-P互作。其中,互作强度暂时或持续上升的E-P互作与造血及免疫过程显著相关(图3)。基于RUNX1结合互作的启动子及增强子区域,该研究预测出与RUNX1协同调控染色质互作的其它转录因子,如GFI1b、PU.1、IRF家族蛋白、SMAD家族蛋白等。该预测结果为RUNX1协同其它转录因子共同调控EHT的机制探究提供了指示方向。
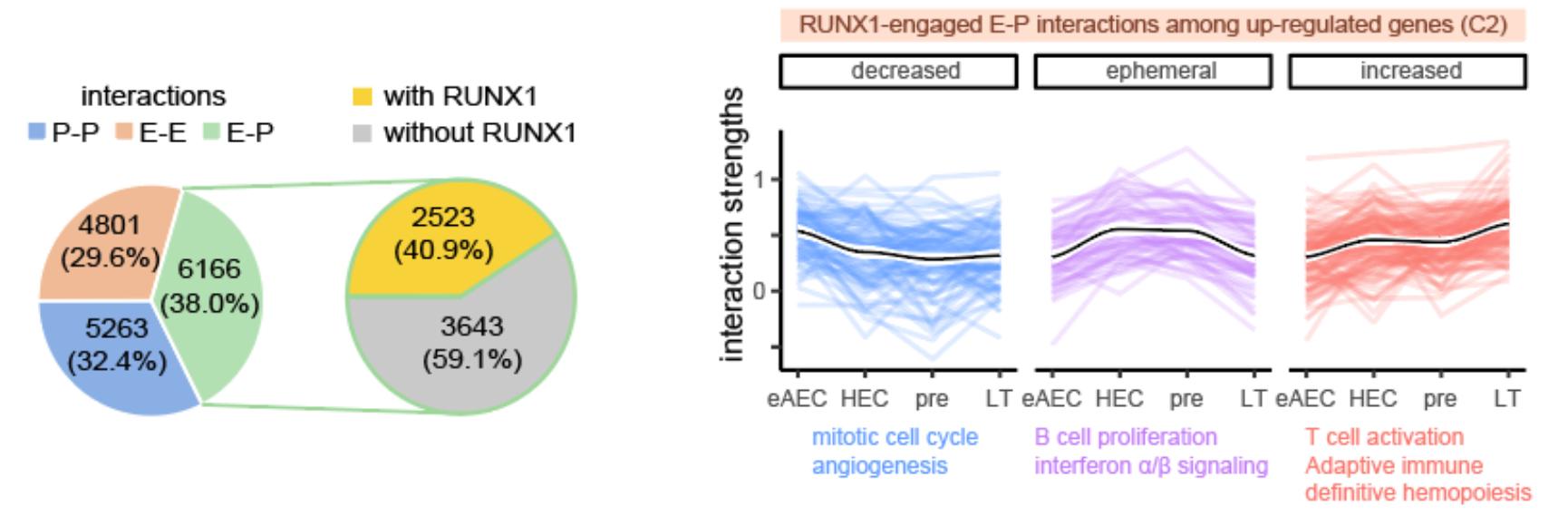
图3. RUNX1参与增强子-启动子(E-P)互作及调控相关生物学过程
该研究突破了体内样品细胞数目限制的技术瓶颈,整合了多层级染色质结构、不同组蛋白修饰及转录因子RUNX1的多组学数据,揭示了HSC起源的表观遗传层级调控新机制。
北京大学未来技术学院分子医学研究所博士李晨、军事科学院博士生张广雨为论文共同第一作者。何爱彬教授、刘兵研究员(解放军总医院第五医学中心)、兰雨研究员(暨南大学)为本文共同通讯作者。感谢清华大学颉伟教授对sisHi-C技术的分享。该研究获得了科技部干细胞专项、国家自然科学基金委、广东省重点研究开发项目、北京大学生命科学联合中心、北京大学高性能计算中心和生命科学学院凤凰平台的大力支持。
北京大学未来技术学院分子医学研究所何爱彬实验室主要开发单细胞/痕量细胞水平的表观遗传学检测技术,以及单细胞实时成像技术,长期诚聘博士后,欢迎发育生物学、表观遗传学、生物信息学、光学等背景的博士加入实验室。
参考文献:
1.Hou S, et al. Embryonic endothelial evolution towards first hematopoietic stem cells revealed by single-cell transcriptomic and functional analyses. Cell Res30, 376-392 (2020).
2.Zhou F, et al. Tracing haematopoietic stem cell formation at single-cell resolution. Nature533, 487-492 (2016).
3.Du Z, et al. Allelic reprogramming of 3D chromatin architecture during early mammalian development. Nature547, 232-235 (2017).
4.Ai S, et al. Profiling chromatin states using single-cell itChIP-seq. Nat Cell Biol21, 1164-1172 (2019).
5.Chen MJ, Yokomizo T, Zeigler BM, Dzierzak E, Speck NA. Runx1 is required for the endothelial to haematopoietic cell transition but not thereafter. Nature457, 887-891 (2009).
6.Lacaud G, et al. Runx1 is essential for hematopoietic commitment at the hemangioblast stage of development in vitro. Blood100, 458-466 (2002).
7.Yokomizo T, et al. Runx1 is involved in primitive erythropoiesis in the mouse. Blood111, 4075-4080 (2008).
8.Wilson NK, et al. Combinatorial transcriptional control in blood stem/progenitor cells: genome-wide analysis of ten major transcriptional regulators. Cell Stem Cell7, 532-544 (2010).
9.Gilmour J, Assi SA, Noailles L, Lichtinger M, Obier N, Bonifer C. The Co-operation of RUNX1 with LDB1, CDK9 and BRD4 Drives Transcription Factor Complex Relocation During Haematopoietic Specification. Sci Rep8, 10410 (2018).
10.Nottingham WT, et al. Runx1-mediated hematopoietic stem-cell emergence is controlled by a Gata/Ets/SCL-regulated enhancer. Blood110, 4188-4197 (2007).