
-

生物通官微
陪你抓住生命科技
跳动的脉搏
上海交大唐鸿志课题组和赵一雷课题组合作阐明非血红素铁双加氧酶NicX的催化机理
【字体: 大 中 小 】 时间:2022年12月21日 来源:上海交大 新闻学术网
编辑推荐:
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室唐鸿志教授课题组和赵一雷教授课题组在Cell Press期刊《Chem Catalysis》在线发表了题为“Dioxetane and Lactone Pathways in Dioxygenolytic Ring Cleavage Catalyzed by 2,5-Dihydroxypyridine Dioxygenase”的研究论文,阐明了一种新型的非血红素铁酶Ni...
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室唐鸿志教授课题组和赵一雷教授课题组在Cell Press期刊《Chem Catalysis》在线发表了题为“Dioxetane and Lactone Pathways in Dioxygenolytic Ring Cleavage Catalyzed by 2,5-Dihydroxypyridine Dioxygenase”的研究论文,阐明了一种新型的非血红素铁酶NicX利用其独特的铁催化中心活化氧气分子,与2,5-二羟基吡啶(DHP)发生加合后以罕见的retro-[2+2]开环降解底物芳香环的反应机制。作者通过计算比较了双氧加合中间体的氧氧键断裂自由基Criegee内酯重排和新型的二氧四环反应途径,发现了该酶具有二氧四环开环的选择性,从而解释了H105F突变体保持活性的实验现象。生命科学技术学院博士生欧阳兴宇为第一作者,唐鸿志教授和赵一雷教授为共同通讯作者。
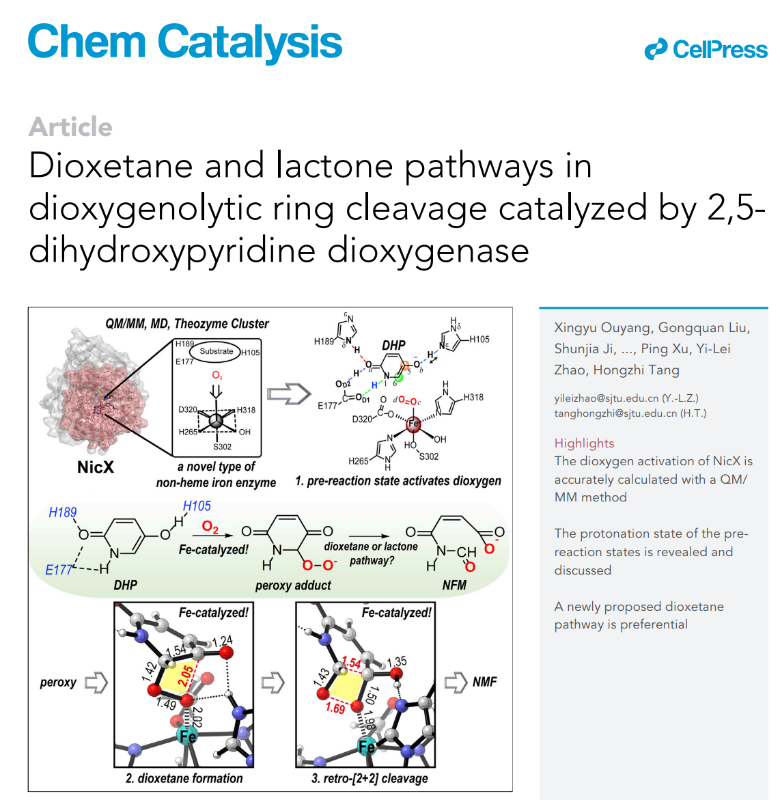
DHP是尼古丁降解过程中的一个难降解吡啶杂环芳香污染物。NicX酶具有特异性催化降解DHP的能力,把它转化为N-甲酰基马来酰胺酸(NFM)后进入微生物的主代谢三羧酸循环。在前期唐鸿志课题组与赵一雷课题组合作的NicX晶体结构解析中发现该酶与传统非血红素铁加氧酶的铁催化中心不同(Liu et al., Nature Communication, 2021, 12: 1301),除了三个常见配基2-His-1-Carboxylate(H265-H318-D320)之外,还存在一个对位丝氨酸残基S302,这种结构类似Heme-Fe-Ser的结构,作者在Nature Comm. 一文中提出了与这种特殊铁配位结构相关的若干种可能催化反应机制,在同行中迅速引起了广泛兴趣,纷纷发表了相关机制的量子化学计算结果。
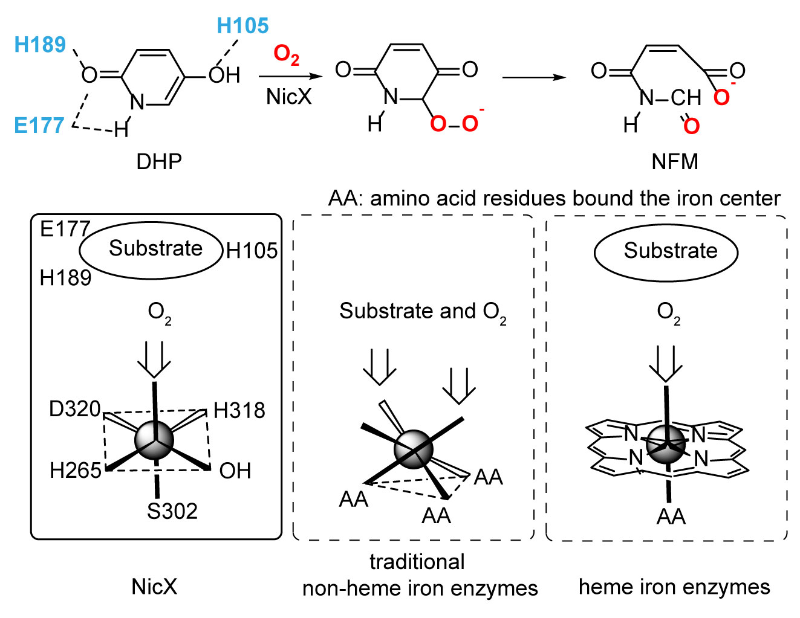
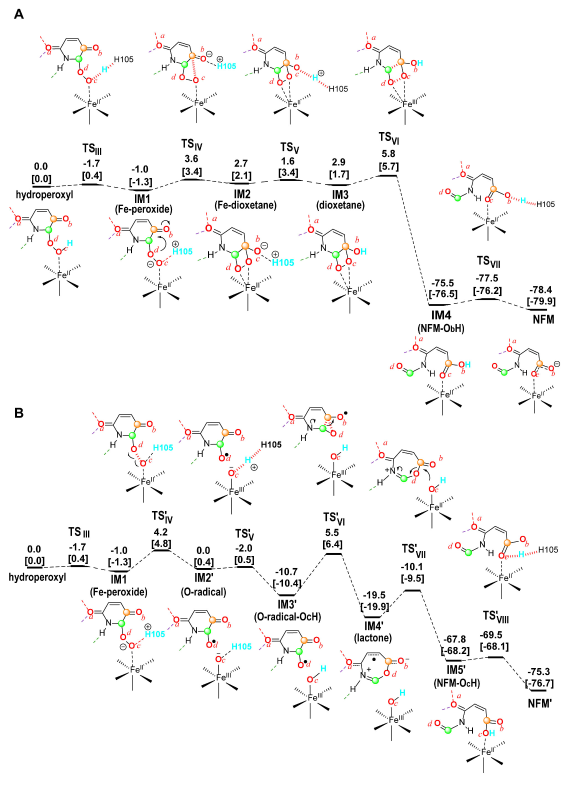
本工作对早期分子机制提出了突破性的更新,发现了二氧四环芳环降解机理:Criegee重排内酯途径的活化能量跨度(δE)高达16 kcal/mol,远高于二氧四环亲核加成-retro[2+2]途径,没有竞争优势。此外,米氏复合物预反应态分析也表明底物分子被H189-E177残基严格约束,与H105形成正负离子对,避免了无效的二次电子传递并提高芳环亲电加合能力。DHP-H105之间的质子穿梭和竞争性开环途径表明该残基在催化中是重要的但又非必要,而铁离子则在氧气活化、亲核加成、开环中都扮演了关键催化角色。该研究成果展示了NicX新型的“2-His-1-Carboxylate-1-Ser”二氧四环催化开环吡啶氮杂环芳香污染物,填补了NicX催化降解机理中一个极为重要的环节。
该工作受到了科技部国家重点研发计划(2018YFA0901200)、国家自然基金(31970041)等项目的支持。
论文链接:https://doi.org/10.1016/j.checat.2022.11.019