
-

生物通官微
陪你抓住生命科技
跳动的脉搏
厦大学者Nature子刊发文:METTL3乙酰化修饰调控其核质动态转位及影响乳腺癌转移机制
【字体: 大 中 小 】 时间:2022年11月01日 来源:厦门大学生命科学学院
编辑推荐:
近日,我院尤涵教授研究团队在Nature Communications上发表题为METTL3 acetylation impedes cancer metastasis via fine-tuning its nuclear and cytosolic functions的研究论文
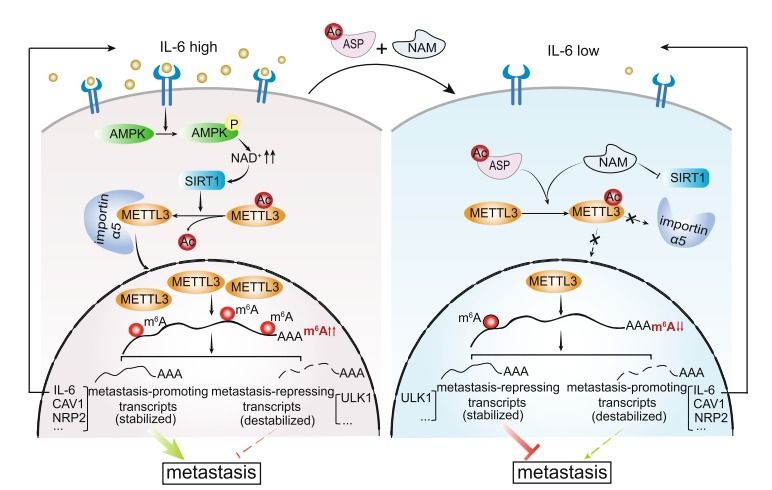
甲基转移酶METTL3(methyltransferase like 3)负责mRNA的N6-腺苷甲基修饰(m6A),通过多种机制调控基因表达和蛋白翻译过程,广泛参与调节细胞生命活动以及多种疾病的发生发展过程。METTL3一直被认为是一个经典的核蛋白。它是否存在胞浆定位?核质转位的调控机制及功能如何?目前尚不清楚。
近日,我院尤涵教授研究团队在Nature Communications上发表题为METTL3 acetylation impedes cancer metastasis via fine-tuning its nuclear and cytosolic functions的研究论文。该研究揭示乙酰化修饰动态调控METTL3的核质定位以及肿瘤侵袭转移的分子机制。

该团队在多种肿瘤细胞系以及临床肿瘤组织样本中发现:METTL3核质分布规律与肿瘤的侵袭转移潜能高度相关。其中高转移的肿瘤细胞中,METTL3以胞核分布为主;低/无转移肿瘤细胞中,METTL3以胞浆分布为主。该研究进一步发现:METTL3乙酰化修饰导致其核质分布差异;p300和SIRT1分别负责METTL3 K177位点的乙酰化/去乙酰化修饰;乙酰化削弱METTL3入核,将其阻滞在胞质,导致转录组m6A整体修饰水平显著降低;其中促转移相关基因(包括IL-6等)显著下调;但是乙酰化诱导的METTL3胞质定位能够显著促进蛋白翻译,上调抑制转移的蛋白表达水平。该工作还揭示肿瘤微环境中的IL-6可以激活AMPK-SIRT1信号通路,促进METTL3去乙酰化并入核,显著上调整体m6A水平,进一步提高IL-6表达,从而形成正反馈环路。该正反馈调节环路对肿瘤转移至关重要。利用移植瘤动物模型,该团队还发现联合使用阿司匹林(ASP)与烟酰胺(NAM)可以通过乙酰化METTL3抑制肿瘤转移。
该工作首次揭示METTL3核质转位的机制与功能;解析炎症信号通过调控表观转录修饰影响肿瘤转移的机制;阐明ASP/NAM药物联用在抗肿瘤转移中的潜力及其分子机制。
厦门大学生命科学学院博士研究生李垣佩、贺枭妞为论文共同第一作者。厦门大学生命科学学院尤涵教授为该论文通讯作者。
原文链接:https://www.nature.com/articles/s41467-022-34209-5
(图/文 尤涵课题组)