
-

生物通官微
陪你抓住生命科技
跳动的脉搏
J Immunother Cancer | 上海药物所合作发现PD-L1/TLR7双靶向纳米抗体偶联药物可重塑肿瘤免疫微环境
【字体: 大 中 小 】 时间:2022年11月01日 来源:中国科学院上海药物研究所
编辑推荐:
该研究论文于2022年10月17日在线发表于Journal for Immunotherapy of Cancer
以免疫检查点抑制剂为代表的肿瘤免疫疗法改变了癌症治疗格局,PD-1/PD-L1阻断疗法在多种肿瘤治疗中取得突破性进展,但其存在响应率低及耐药复发等问题,发现新型PD治疗策略提高疗效是亟待解决的问题。Toll样受体(Toll-like receptor,TLR)是先天免疫重要靶点,其激动剂可有效将冷肿瘤变热,解决单免疫检查点抑制剂响应率低的问题。抗体小型化是基因工程领域研究方向之一,纳米抗体,即重链单域抗体,是驼科鲨鱼科等动物缺失轻链的天然重链抗体的可变区,是目前已知的天然存在的结合抗原的最小单位。与单克隆抗体相比,纳米抗体具有更优越的肿瘤靶向性和稳定性,可实现药物的靶向递送从而实现精准治疗。
近日,中国科学院上海药物研究所宫丽崑课题组、李佳课题组以及深圳大学靳广毅课题组合作开发了PD-L1/TLR7双靶向纳米抗体偶联药物(Nanobody drug conjugate,NDC),其可通过重塑肿瘤免疫微环境发挥强劲抗肿瘤作用,并显示出临床开发的前景。该研究论文于2022年10月17日在线发表于Journal for Immunotherapy of Cancer。

研究团队利用噬菌体展示技术获得了阻断型抗PD-L1纳米抗体Nb16,其可显著抑制肿瘤生长且与单抗相比展现出更强的肿瘤穿透性;此外,TLR7激动剂SZU-101可激活先天免疫细胞并诱导抗原提呈细胞(antigen-presenting cells,APC)和肿瘤细胞上PD-L1的表达上调。进一步,研究团队评价了PD-L1/TLR7双靶向NDC的体内抗肿瘤作用,发现其相比于联合用药组具有更为显著的抗肿瘤活性;且可重塑肿瘤免疫微环境,促进APC包括巨噬细胞表达PD-L1,不仅对高表达PD-L1的“热”肿瘤有显著抗肿瘤作用,也可用于PD-L1低表达的“冷”肿瘤的抗肿瘤治疗,此外,其在早期肿瘤和晚期肿瘤模型中均展现出抗肿瘤作用,且可部分实现肿瘤消退;而且肿瘤消退小鼠的再荷瘤模型中,小鼠在40天内均不再生长肿瘤,表明NDC诱导了有效的抗肿瘤免疫记忆。在机制研究上,研究团队发现,PD-L1/TLR7双靶向NDC的药效发挥主要依赖于NK细胞和CD8+T细胞,且随着给药进程可动态调控肿瘤组织中PD-L1的表达,有利于NDC的进一步肿瘤靶向递送,其抗肿瘤作用主要依赖于宿主PD-L1轴的表达。经典抗体及其ADC由于其体积大,难以穿透实体瘤;纳米抗体偶联小分子激动剂很好的解决了经典抗体ADC的问题,开创了ADC新的方向领域;该研究为新型纳米抗体偶联药物的开发提供了夯实的理论依据和实验基础。
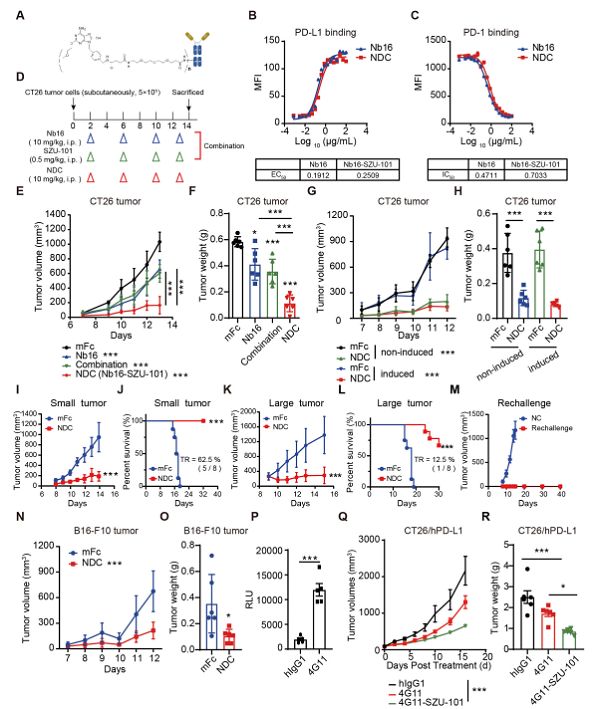
NDC体内抗肿瘤作用
该研究论文第一作者为上海药物所博士后尉骁璐和博士研究生龙益如。上海药物所宫丽崑研究员、李佳研究员和深圳大学靳广毅教授为本论文通讯作者。研究工作得到了重大新药创制科技重大专项和中国科学院战略性先导科技专项的资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/36253000/
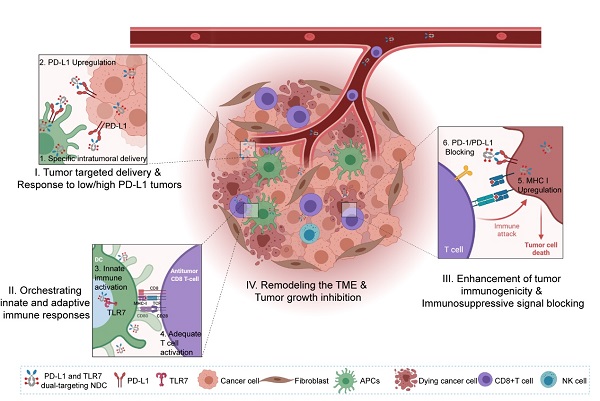
PD-L1/TLR7双靶向纳米抗体偶联药物可重塑肿瘤免疫微环境
(供稿部门:宫丽崑课题组)