
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature杂志发表姜长涛教授团队重要研究成果
【字体: 大 中 小 】 时间:2022年10月26日 来源:北京大学基础医学院
编辑推荐:
文章链接: https://doi.org/10.1038/s41586-022-05299-4 2022 年 10 月 20 日,国际学术期刊 Nature 发表了北京大学 医学部 基础医学院、北京大学第三医院医学创新研究院姜长涛教授团队 和合作者 的研究论文 “Gut bacteria alleviate smoking-related NASH by degrading gut nicotine”
肠道菌群通过降解尼古丁,改善吸烟加重的非酒精性脂肪肝炎
烟草的使用是全球疾病和死亡的最主要可预防性因素。我国直接吸烟人口超过3亿,被动暴露于烟雾环境中的人数更是难以统计。众所周知,吸烟不仅是肺癌重要的致病因素,更与心血管疾病、糖尿病等多种代谢性疾病息息相关。近年来多项流行病学证据显示,长期吸烟与非酒精性脂肪肝炎(NASH)的进程密切相关,但其分子机制和干预策略研究仍为空白。因此,解析吸烟加重NASH的主要成分、作用部位、分子机制及潜在调控方式,对于加深理解吸烟危害、开发相应靶向干预措施具有重要意义。

文章链接:https://doi.org/10.1038/s41586-022-05299-4
2022年10月20日,国际学术期刊Nature发表了北京大学医学部基础医学院、北京大学第三医院医学创新研究院姜长涛教授团队和合作者的研究论文“Gut bacteria alleviate smoking-related NASH by degrading gut nicotine”。该论文揭示了烟草摄入期间尼古丁在肠道累积,通过肠道—肝脏交互调控促进NASH进展的新型分子机制。团队首次发现了人体肠道菌群对肠道尼古丁的降解作用,并揭示了其中的关键肠道共生菌—解木聚糖拟杆菌(Bacteroides xylanisolvens)及新型尼古丁代谢酶NicX:解木聚糖拟杆菌通过NicX降解肠道尼古丁,有效缓解吸烟加重的NASH。该研究发现吸烟过程中尼古丁于肠道累积,阐明其对NASH的促进作用及分子机理,揭示肠道共生菌在尼古丁相关的NASH发病中的关键保护作用,为吸烟相关代谢性疾病的基础研究与临床干预提供了新靶点与新策略。
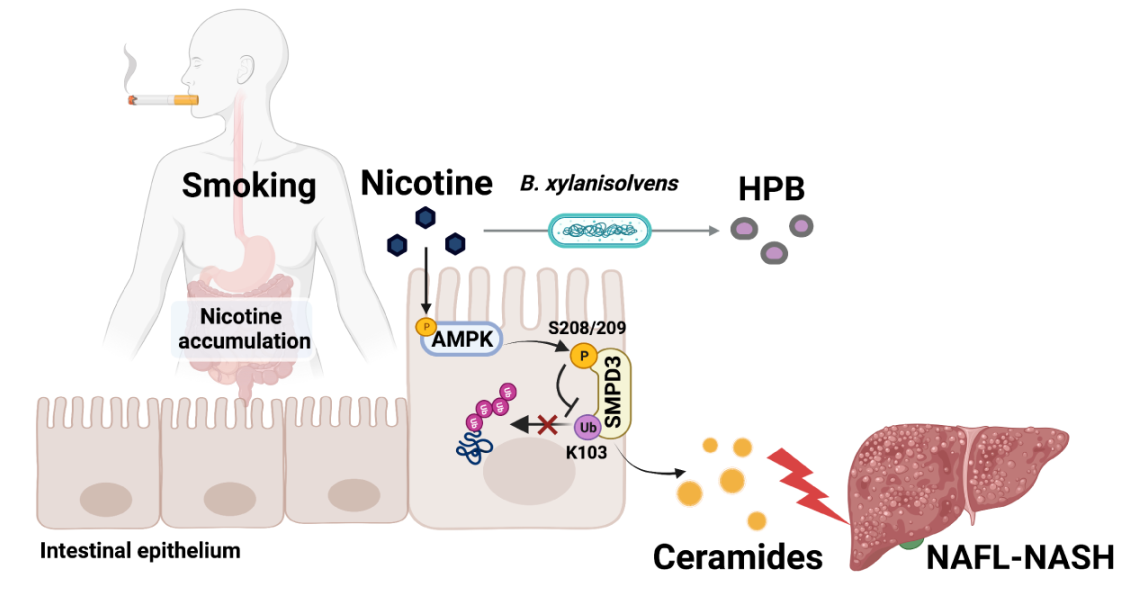
图1. 肠道共生菌降解尼古丁,改善吸烟过程中肠道尼古丁累积对NASH的加重作用
此前尼古丁相关研究主要关注其对肺和脑等器官的影响,为了更加全面和准确地探究不同组织中尼古丁的分布与功能,研究人员利用代谢组学对吸烟人群及多种尼古丁暴露小鼠模型中的不同组织进行尼古丁含量精确测定,意外发现吸烟或尼古丁暴露期间,尼古丁在肠道大量累积。更值一提的是,尼古丁处理后,无菌(GF)小鼠回肠及其内容物中的尼古丁浓度显著高于正常SPF小鼠,提示肠道菌群具有在体降解肠道尼古丁的潜力。通过对吸烟人群粪便样本的宏基因组学分析,结合一系列体内与体外实验、合成生物学手段以及色谱与光谱技术,研究人员发现肠道共生菌解木聚糖拟杆菌(Bacteroides xylanisolvens)可以通过尼古丁代谢酶NicX将肠道尼古丁高效降解为4-羟基-1-(3-吡啶)-1-丁酮(HPB)。通过解木聚糖拟杆菌(野生型和NicX敲除株)在高脂高果糖高胆固醇饮食(HFHFrC)叠加尼古丁的NASH小鼠模型定植实验,研究人员证实解木聚糖拟杆菌可以通过NicX依赖的方式缓解尼古丁促进的NASH进程。
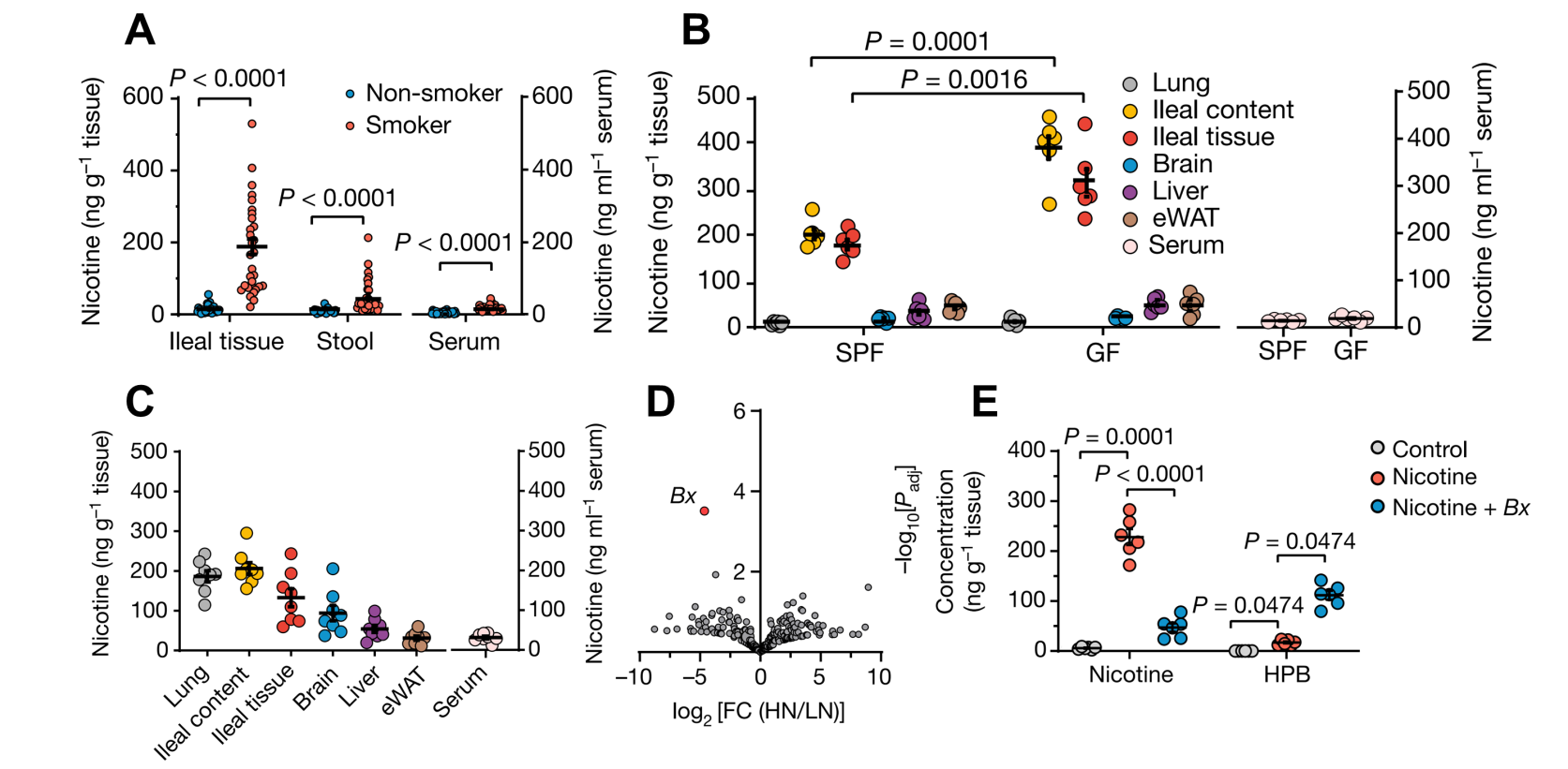
图2. 吸烟引起尼古丁肠道积累,肠道尼古丁可被肠道共生菌高效降解
研究人员运用磷酸化蛋白组学、脂质组学等多组学联用技术以及多个肠上皮细胞特异性基因敲除小鼠模型,发现肠道尼古丁蓄积显著激活肠上皮细胞AMPKα1信号,通过上调鞘磷脂磷酸二脂酶3(SMPD3)磷酸化水平,促进肠源神经酰胺的分泌。进一步,研究人员确定了AMPKα1可以直接结合SMPD3并磷酸化S208(S209)位点,抑制K103位点泛素化,进而抑制SMPD3蛋白酶体降解途径,最终增加SMPD3活性。这一发现首次将AMPK信号与鞘脂神经酰胺代谢联系起来,揭示了AMPK新的重要功能。
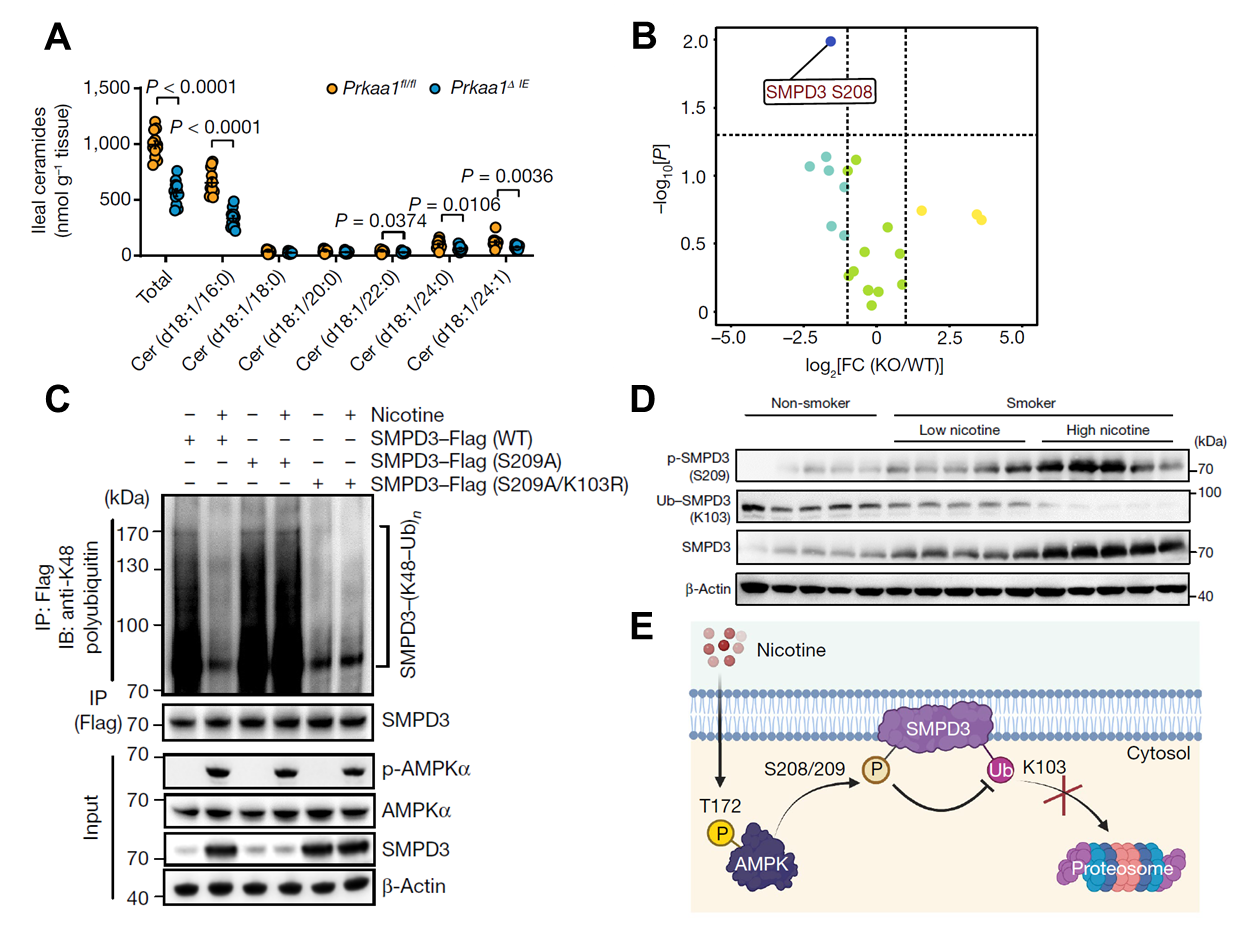
图3. 尼古丁通过肠AMPKα—SMPD3轴,促进肠源神经酰胺生成
随后,研究人员招募了83例经肝脏活检证实的NAFLD患者,利用其粪便样本进行了宏基因组、代谢组学检测以及关联分析。结果显示,吸烟者粪便中的尼古丁水平与NAFLD-NASH进程的严重程度呈正相关,而B. xylanisolvens丰度、尼古丁的降解产物HPB则与NASH进程呈负相关。以上发现为靶向特定肠道菌群及其代谢酶治疗尼古丁相关NASH进展提供了新策略。
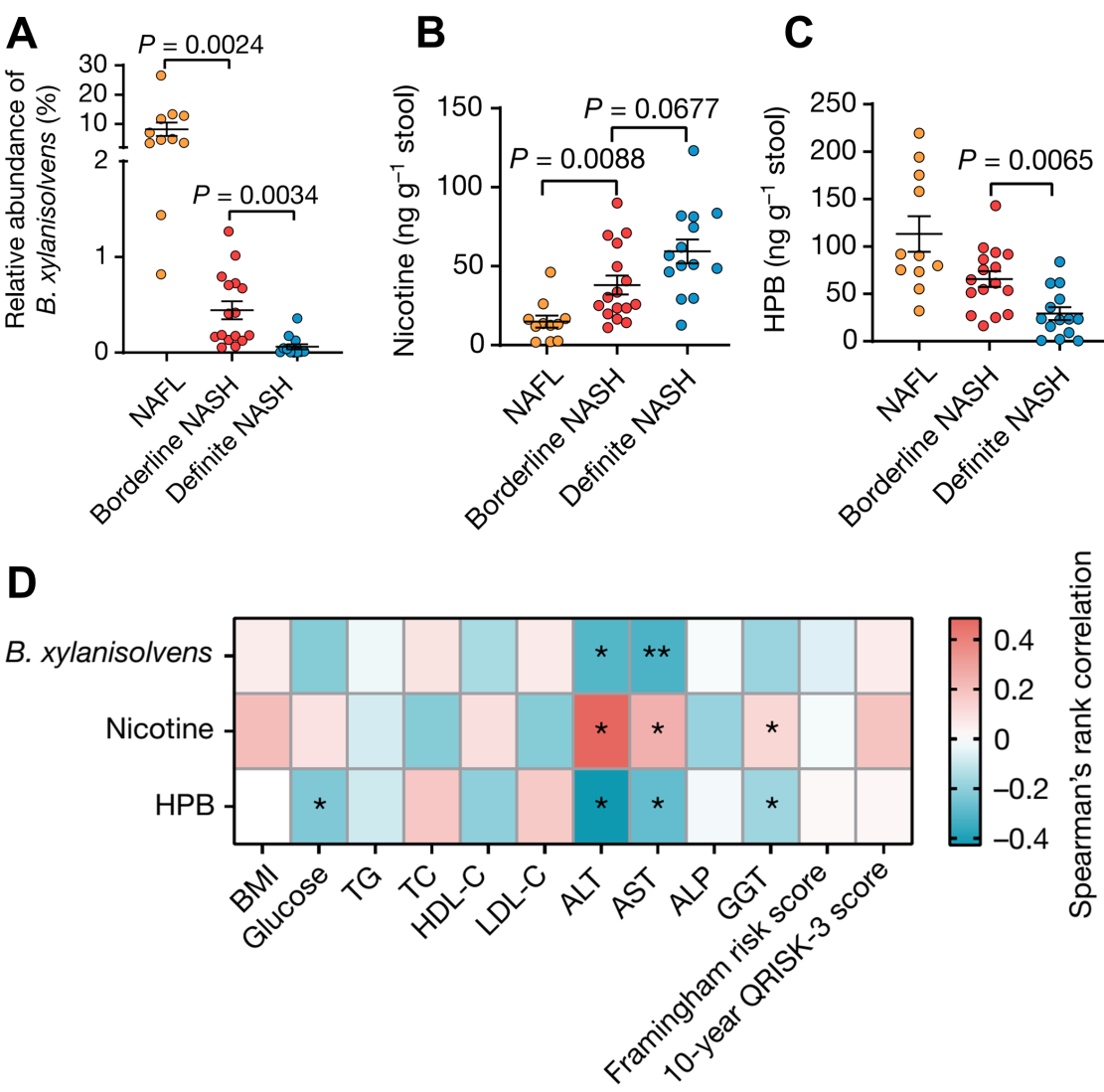
图4. B. xylanisolvens介导的尼古丁降解与吸烟者的NASH进程呈负相关
北京大学医学部基础医学院是该论文的第一完成单位,北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授、美国国立卫生研究院Frank Gonzalez研究员、浙江大学医学院第一附属医院虞朝辉教授、复旦大学基础医学院李洋研究员以及温州医科大学附属第一医院郑明华教授是这一成果的共同通讯作者。北京大学医学部基础医学院2013级基础八年制陈博、美国国立卫生研究院博士后孙露露、北京大学基础医学院博士研究生曾广易、浙江大学医学院第一附属医院沈哲教授、北京大学基础医学院博士后汪锴、复旦大学基础医学院博士研究生尹利敏为本文的共同第一作者。本研究得到国家自然科学基金“糖脂代谢的时空网络调控”重大研究计划、国家杰出青年科学基金、国家重点研发计划等经费支持。
作者简介

姜长涛,北京大学长聘教授、博雅特聘教授,北京大学基础医学院副院长。
主要从事代谢性疾病的发病机制与转化医学研究,重点关注肠道微生态在其中的作用。近5年以通讯作者在Nature、Nature Medicine(3篇)、Cell Metabolism(3篇)、Journal of Clinical Investigation及Diabetes(2篇)等杂志发表SCI论文二十余篇,获授权发明专利4项。入选国家杰出青年科学基金获得者、教育部青年长江学者、国家“万人计划”青年拔尖人才等人才计划;获得第十六届中国青年科技奖、第八届树兰医学青年奖、第六届北美华人糖尿病学会(CADA)青年科学家奖等奖励;主持国家自然科学基金重点项目、重大研究计划及国家重点研发计划等十余项基金,作为PI获得国家自然科学基金创新研究群体项目;作为大会主席,主办中国科协第295次青年科学家论坛“代谢调控与靶标发现前沿会”、2021中国肠道大会,并担任中国生物物理学会肠道菌群分会秘书长、北京生理学会生理专业委员会主任委员、《遗传》杂志副主编、《Science Bulletin》杂志编委等学术职务。
(北京大学基础医学院)