
-

生物通官微
陪你抓住生命科技
跳动的脉搏
封面文章 | 磷酸丝氨酸氨基转移酶1(PSAT1)促进肺腺癌EGFR-TKIs耐药和转移的新机制
【字体: 大 中 小 】 时间:2022年10月10日 来源:上海交通大学医学院
编辑推荐:
10月4日,上海交通大学医学院药理学与化学生物学系沈瑛课题组在肿瘤学研究领域经典期刊Cancer Research发表封面文章“Metabolic and non-metabolic functions of PSAT1 coordinate signaling cascades to confer EGFR-inhibitor resistance and drive progression in lung adenocarcinoma”,揭示PSAT1兼具代谢酶活性及非代谢调控的蛋白互作功能,协同调控ROS/JNK/c-Jun和IQGAP1-STAT3信号轴,共同促进肺腺癌耐药和转移的创新机制
10月4日,上海交通大学医学院药理学与化学生物学系沈瑛课题组在肿瘤学研究领域经典期刊Cancer Research发表封面文章“Metabolic and non-metabolic functions of PSAT1 coordinate signaling cascades to confer EGFR-inhibitor resistance and drive progression in lung adenocarcinoma”,揭示PSAT1兼具代谢酶活性及非代谢调控的蛋白互作功能,协同调控ROS/JNK/c-Jun和IQGAP1-STAT3信号轴,共同促进肺腺癌耐药和转移的创新机制。

如封面所示:磷酸丝氨酸氨基转移酶1(PSAT1)就像高速运转的机械转盘,上方装载灵活精巧的机械手臂(代谢酶活性)调控细胞内氧化还原平衡(红、蓝气泡),下方装载伸缩自如的椭圆吸盘(蛋白互作功能),募集并激活IQGAP1-STAT3信号轴(紫-粉蛋白卡通),共同促进肺腺癌对Erlotinib耐药和转移。近期Cancer Research杂志中已发表多篇研究论文和综述探讨代谢重编程及其关键酶在肿瘤恶性进展和临床预后之间的关系,沈瑛团队文章荣幸被选为当期封面刊登,充分体现出该论文的重要发现和潜在引领作用,也生动展现了研究成果蕴含的科学理念和创新之处。

Cancer Research当期封面文章(2022 Oct 1;82(19):3516–31)
PSAT1兼具代谢酶活性及非代谢调控的蛋白互作功能
上海交通大学医学院沈瑛研究员为该论文通讯作者。上海交通大学医学院2021级博士研究生罗鸣宇、毕业硕士生周烨和顾玮铭为论文共同第一作者。该工作得到了上海中医药大学交叉科学研究院陈红专教授、上海交通大学医学院朱亮教授、上海交通大学医学院附属仁济医院庄光磊研究员、上海中医药大学附属岳阳医院许玲教授等多位专家指导和支持,以及教育部共建上海市生物医药临床研究与转化协同创新中心、细胞分化与凋亡教育部重点实验室、细胞稳态调控疾病前沿科学中心、上海交通大学基础医学院公共技术平台提供大力支撑;项目获得国家自然科学基金和上海市科委项目等资助。
专家点评

傅海安教授 美国埃默里(Emory)大学
每当我们庆祝新一代抗癌药物的成功,肿瘤就已经筑起了抗药的壁垒,导致药效的降低,甚至治疗的失败。所以揭示肿瘤内rewired oncogenic programs和抗耐药分子机理对我们发展新药,临床应用意义重大。近年来,越来越多研究阐明肿瘤代谢酶兼具代谢酶活性及非代谢调控的多重功能,在肿瘤恶性进展中发挥重要作用,已成为抗肿瘤药物新靶标研究的前沿热点。但是对于肿瘤代谢酶多重功能的相关研究尚未透彻。Erlotinib等表皮生长因子受体酪氨酸激酶(EGFR)抑制剂分子靶向药物治疗肺腺癌疗效显著,但极易耐药、引起患者肿瘤复发及转移,深入研究肿瘤耐药和转移的肿瘤代谢酶机制有助于改进肿瘤治疗策略。
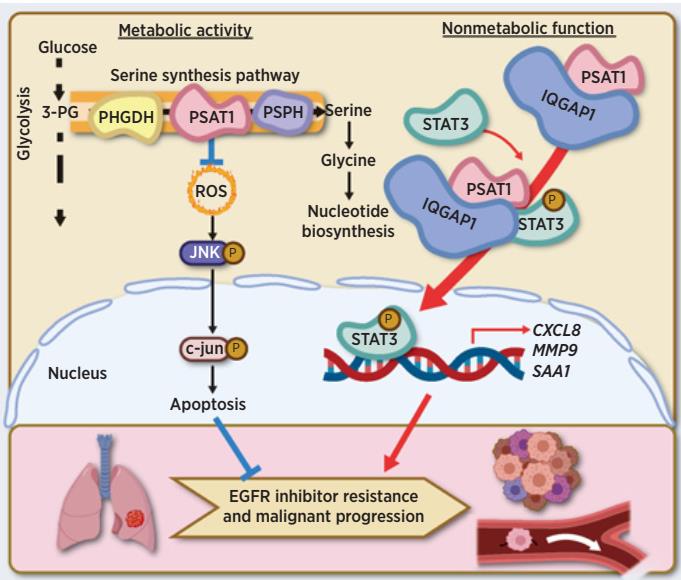
PSAT1是丝氨酸合成通路的关键酶之一,它催化3-磷酸羟基丙酮酸(3-PPyr)转化成磷酸丝氨酸(p-serine),p-serine可进一步生成丝氨酸和甘氨酸,参与下游一碳代谢和核酸代谢;PSAT1同时催化细胞中谷氨酸生成α-酮戊二酸(α-KG)进入三羧酸循环,参与复杂代谢网络调控,为肿瘤细胞提供增殖所需物质基础及能量,并维持胞内氧化还原平衡。
2022年10月4日,上海交通大学医学院沈瑛研究员课题组在Cancer Research上以长文(Article)形式在线发表题为“Metabolic and non-metabolic functions of PSAT1 coordinate signaling cascades to confer EGFR-inhibitor resistance and drive progression in lung adenocarcinoma”的封面文章,报道了丝氨酸合成通路关键酶PSAT1兼具经典的代谢酶活性及非代谢调控的蛋白互作功能,协同调控ROS/JNK/c-Jun和IQGAP1-STAT3信号轴,促进肺腺癌对EGFR抑制剂耐药和转移。
该研究发现在肺腺癌细胞经Erlotinib短期适应性耐药和长期获得性耐药过程中,葡萄糖来源从头合成的丝氨酸及其合成通路关键酶PHGDH、PSAT1和PSPH蛋白水平均显著增加。敲低PSAT1能优先抑制耐药细胞的增殖及运动,恢复耐药细胞对Erlotinib的敏感性,增强Erlotinib对肺腺癌的杀伤作用。反之过表达PSAT1可促进肺腺癌Erlotinib耐药和肿瘤转移。机制研究表明PSAT1不仅通过丝氨酸合成通路调控肺腺癌细胞内氧化还原稳态,还能不依赖于其经典代谢酶活性,和IQGAP1蛋白相互作用,随后募集并激活下游STAT3信号通路,从而促进肺腺癌EGFR-TKIs耐药和转移。临床样本数据库分析结果证实PSAT1水平与肺腺癌患者的恶性进展和转移显著正相关,PSAT1-IQGAP1-STAT3信号轴与患者较差的预后密切相关。
该研究成果揭示了PSAT1促进肺腺癌EGFR-TKIs耐药和转移的新机制,为深入研究PSAT1与肺腺癌恶性进展之间的关系提供实验理论基础,为靶向PSAT1的抗肿瘤药物定向设计提供新的思路。值得关注的是,以往研究报道发现肿瘤特异性蛋白-蛋白相互作用(OncoPPI)广泛存在,为探索潜在的新型抗癌药物靶点提供了丰富的资源和巨大的机遇。对新发现的促肺腺癌的PSAT1和PSAT1-IQGAP1 oncoPPI的进一步研究有望加速新一代抗癌药物的研发。
 生物通微信公众号
生物通微信公众号
知名企业招聘