
-

生物通官微
陪你抓住生命科技
跳动的脉搏
DNA复制和修复过程中核酸酶Dna2与单链DNA结合蛋白RPA的相互作用机制
【字体: 大 中 小 】 时间:2022年01月27日 来源:生命科学联合中心
编辑推荐:
齐志团队与合作者揭示DNA复制和修复过程中 核酸酶Dna2与单链DNA结合蛋白RPA的相互作用机制 ? 单链DNA作为中间体广泛地存在于各种DNA新陈代谢通路中。在真核生物中,单链DNA结合蛋白RPA作为单链DNA的守护者,其存在对于DNA复制和DNA修复都是不可或缺的。RPA不仅可以保护单链DNA的完整性,还可以引导...
单链DNA作为中间体广泛地存在于各种DNA新陈代谢通路中。在真核生物中,单链DNA结合蛋白RPA作为单链DNA的守护者,其存在对于DNA复制和DNA修复都是不可或缺的。RPA不仅可以保护单链DNA的完整性,还可以引导下游因子发出信号或者修复单链DNA中间体。然而,目前尚不清楚下游的酶以及因子如何在与RPA的竞争中胜出并结合单链DNA。在众多与RPA相互作用的因子中,Dna2是一种进化上保守的核酸酶并且在消化RPA结合的单链DNA过程中发挥着独特的作用,使得Dna2在DNA复制后随链成熟过程中以及DNA双链断裂修复过程中都发挥着重要的作用。在DNA复制中,后随链复制中形成的5’-flap必须在后随链成熟过程中被移除。在这一过程中,Dna2参与移除结合RPA的长5’-flap,使得Fen1核酸酶可以进一步移除5’-flap并促进后随链成熟。在同源重组介导的双链断裂修复过程中, Dna2协同Sgs1解旋酶参与切除断裂DNA末端的一段5’-单链DNA从而形成下游模版搜索以及链交换所需的3’-单链DNA。
2022年1月18日,北京大学定量生物学中心齐志实验室与美国印第安纳大学牛恒尧实验室以及美国贝勒医学院Grzegorz Ira实验室在Nature Communications杂志发表题为Deciphering the mechanism of processive ssDNA digestion by the Dna2-RPA ensemble的文章。

该研究发现在真核模式生物酿酒酵母中,Dna2可与 RPA形成稳定复合物在单链DNA上“行走”并且行进性消化单链DNA(图1),而支持该行进性消化的关键便是Dna2与RPA相互作用形成的顺式界面与反式界面。在顺式相互作用中, RPA负责将结合的单链DNA主动运送给Dna2完成行进性消化。而在反式相互作用中,Dna2通过自身的一段酸性氨基酸区域,招募溶液中的RPA或结合单链DNA二级结构的RPA,从而加强Dna2行进行消化能力。该反式相互作用的缺失并不影响酵母细胞的存活,但对于DNA双链断裂修复是不可或缺的。
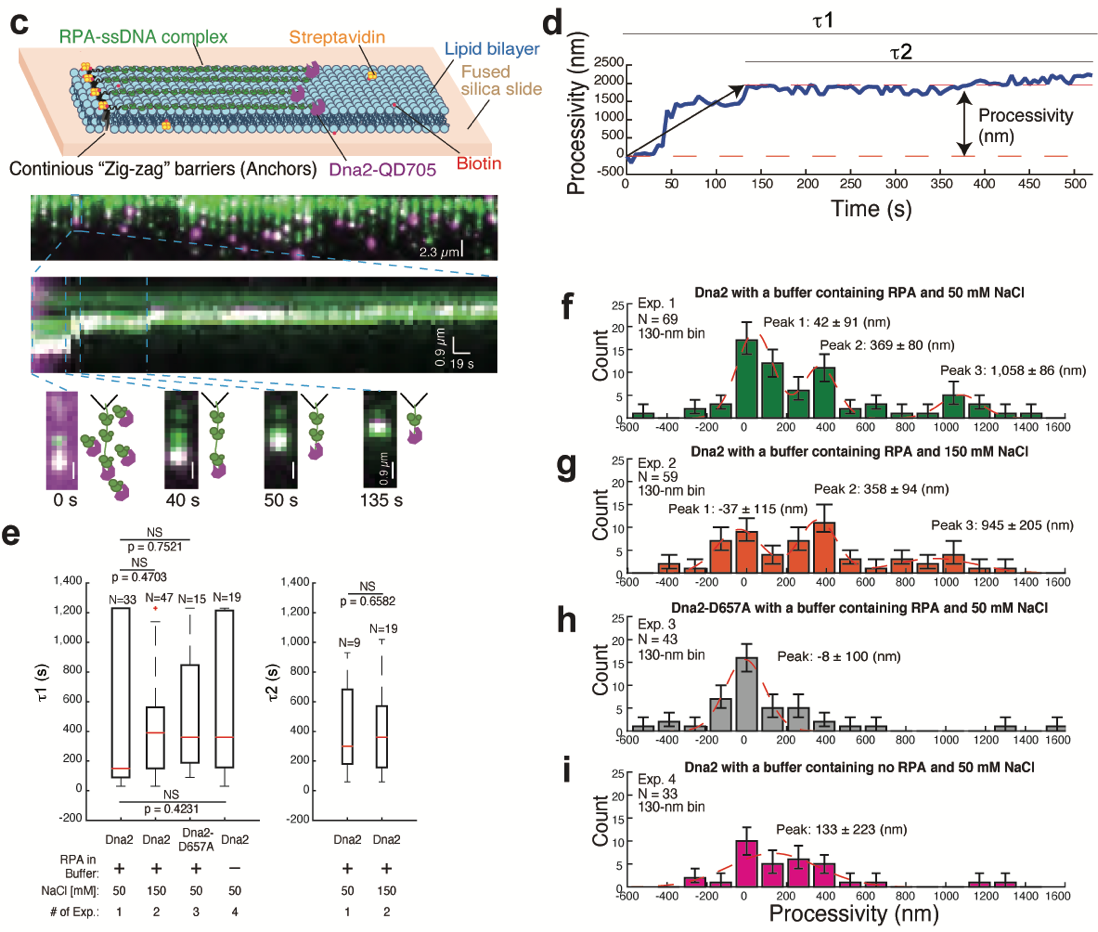
图1. DNA幕帘技术揭示Dna2可行进性消化RPA结合的5’-单链DNA。
该研究发现Dna2可以选择性地与RPA在5’-单链DNA底物上形成稳定三元复合物(图2),并揭示了RPA中的Rfa1大亚基的N端对于该三元复合物的形成是至关重要的,从而从机理上解释了之前报道的Dna2对于5’-单链DNA的选择性活性。更令人吃惊的是,当结合单链DNA的RPA被替换成缺失Rfa1大亚基N端的突变体(RPA-∆N)后,Dna2仍然可以与溶液中后续加入的RPA在单链DNA的5’-末端形成稳定三元复合物并完成进行消化(图2)。
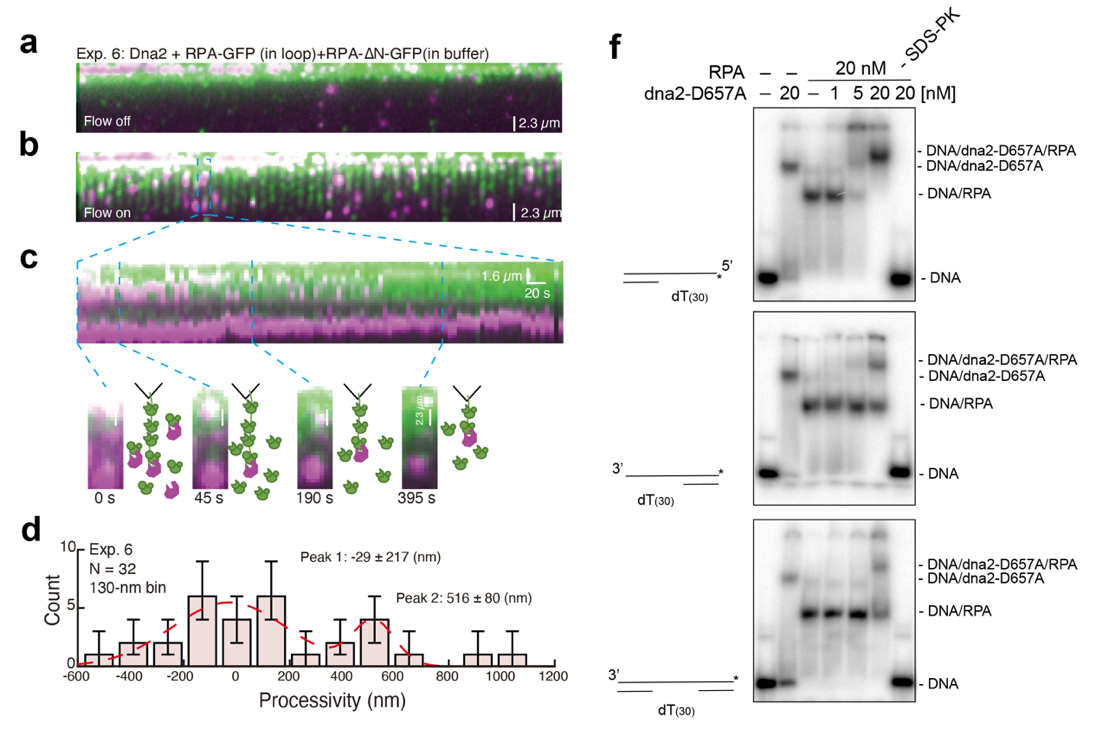
图2. DNA幕帘技术揭示Dna2可行进性酶切RPA结合的5’-单链DNA。
作者进一步深入探究发现RPA的Rfa1大亚基的NAB结构域(Rfa1-NAB)不仅可以与Dna2在单链DNA上形成三元复合物,并且可以替代RPA支持Dna2的行进性消化(图3)。将Rfa1-NAB与Dna2的N端截短(dna2-∆248N)粘合在一起而形成的融合蛋白(NAB-dna2-∆248N)依旧可以支持行进性的单链DNA消化,而不需要外源加入的RPA或者Rfa1-NAB,进而更深层次地验证了Dna2与RPA在单链DNA上形成的三元复合物对于单链DNA的行进性消化是充分且必要的。
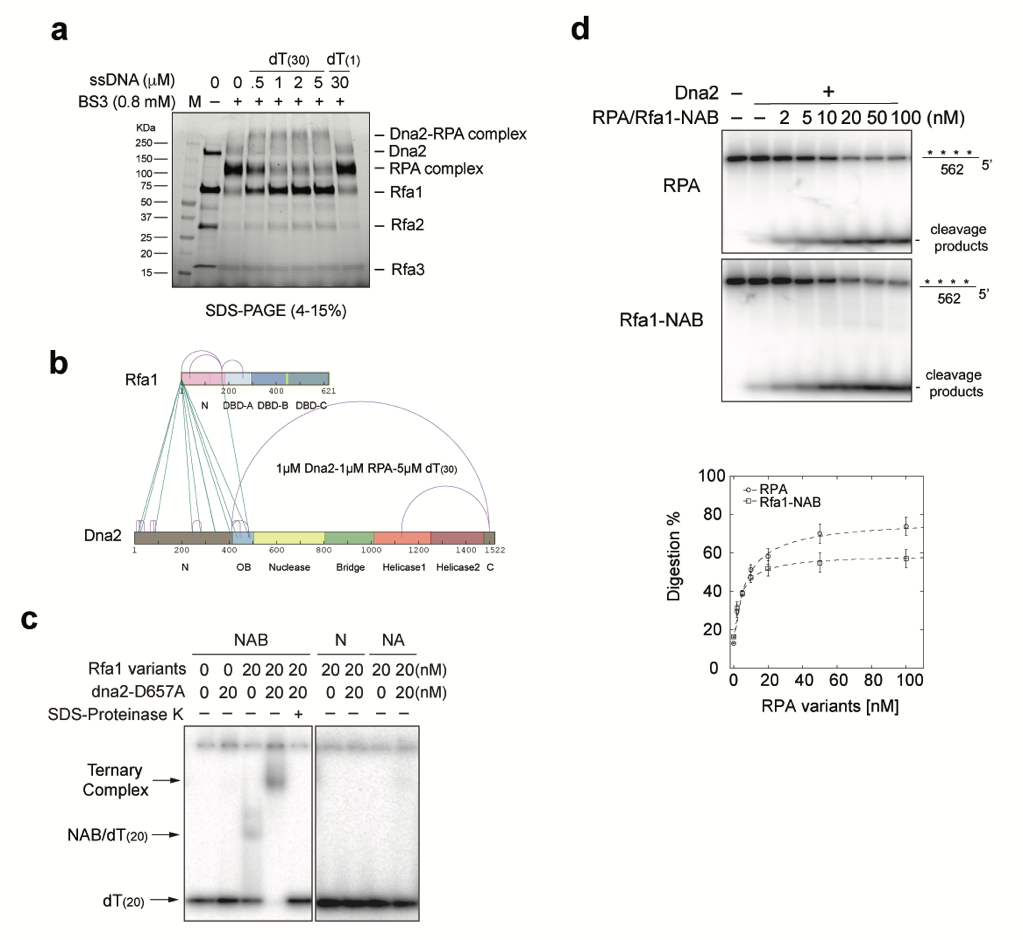
图3.蛋白质交联结果的质谱分析显示Rfa1-N与Dna2-N-OB区域相互作用。
作者同时在研究融合蛋白NAB-dna2-∆248N的过程中,发现其虽然可以行进性消化单链DNA,但却无法有效消化单链DNA中包含的复杂二级结构区域,以及无法在单链DNA/双链DNA交界处完成消化后有效脱离底物。造成这些问题的关键之处,可能是在NAB-dna2-∆248N融合蛋白中Dna2与RPA的反式相互作用被抑制,而无法与溶液中的RPA或结合单链DNA二级结构的RPA有效相互作用。在Dna2中,负责与RPA的反式相互作用的区域是位于Dna2的N端的一段酸性氨基酸区域(图4)。突变这段酸性氨基酸而形成的Dna2突变体(dna2-AC)仍可以与RPA在单链DNA上形成三元复合物,但与RPA在溶液中的相互作用则明显变弱。遗传学上,dna-AC突变株酵母本身可存活,但对DNA双链断裂诱导剂(phleomycin)药物处理非常敏感。利用同体转换核酸内切酶测试(HO endonuclease assay),发现AC结构域对于Dna2在酵母体内进行长程切除(long-range resection)的活性是至关重要的。

图4.Dna2AC区域负责与RPA反式相互作用且相应酵母突变体对DNA双链断裂敏感。
综合该论文报道的结果,作者提出了Dna2-RPA复合物消化单链DNA的全新模型(图5)。在细胞内出现适合RPA结合的单链DNA时,RPA会迅速结合单链DNA区域并招募诱导Dna2在开放5’-单链DNA的末端形成Dna2-RPA-单链DNA顺式三元复合物,从而启动单链DNA的行进性消化。RPA作为该复合物中的行进性单元,为Dna2不断输送单链DNA从而促进其消化。同时,在该模型中,Dna2-RPA复合物可以形成反式复合物来克服消化包含复杂二级结构的单链DNA区域的问题。与顺式复合物不同的是,Dna2通过其N端的AC结构域与溶液中的RPA或者结合非5’-单链DNA的末端的RPA发生相互作用,并可能诱导顺式复合物中的RPA被瞬间交换,而这也有待于今后的研究工作的进一步证明。
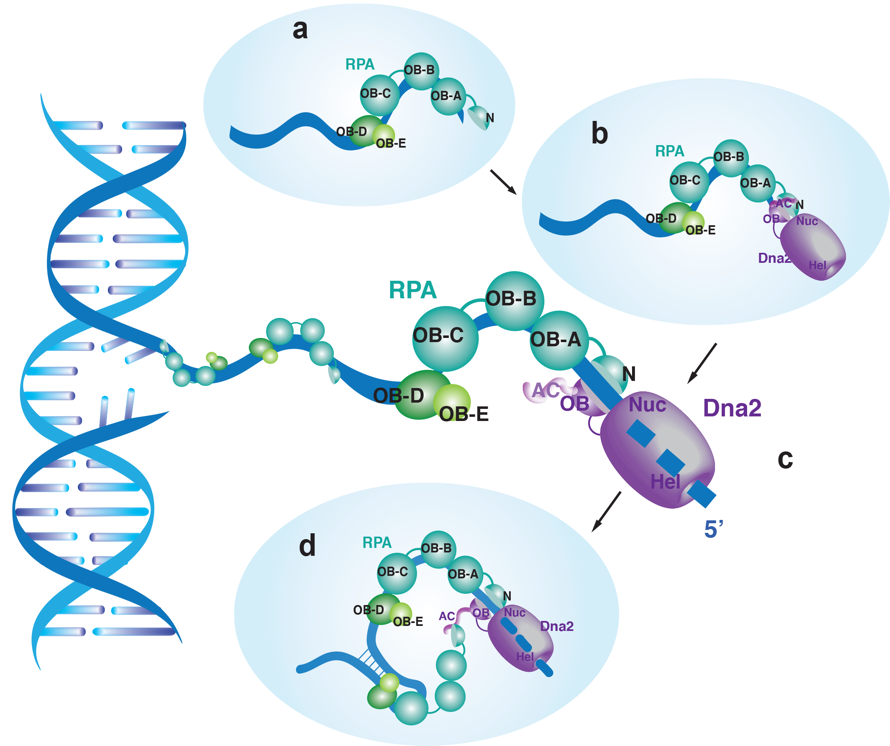
图5. Dna2-RPA复合物消化单链DNA的全新模型。
印第安纳大学博士后沈江川,北大清华生命科学联合中心赵奕玲博士,以及贝勒医学院Nhung Tuyet Pham博士为该论文共同第一作者。北京大学定量生物学中心齐志研究员与印第安纳大学牛恒尧教授与为该论文的共同通讯作者。贝勒医学院Grzegorz Ira教授,印第安纳大学李钰茜博士,印第安纳大学生物质谱中心张翼翔博士以及中心主任Jonathan Trinidad博士为本论文的共同作者。德克萨斯大学圣安东尼奥分校Patrick Sung教授为本课题提供Dna2相关质粒并且为该课题早期发展阶段提供资金支持并参与讨论提供建议。德克萨斯大学奥斯汀分校Ilya Finkelstein教授为本课题提供RPA相关质粒。印第安纳大学Hayley Bedwell以及耶鲁大学Alex Chern在该课题早期发展阶段提供技术支持。爱荷华大学Marc Wold教授在该课题早期发展阶段参与讨论并提供建议。该课题得到自然科学面上基金(No. 31670762 to Z.Q)支持。