
-

生物通官微
陪你抓住生命科技
跳动的脉搏
高仁钧教授团队在酶法降解酚类污染物方面取得重要进展
【字体: 大 中 小 】 时间:2021年12月14日 来源:吉林大学生命科学学院
编辑推荐:
相关研究内容已于近日以题为 A new thermophilic extradiol dioxygenase promises biodegradation of catecholic pollutantsjiesh 在线发表于 Journal of Hazardous Materials (2022,422:126860) 儿茶酚类物质作为重要的化学试剂广泛地被应用于制药工业、化工、化妆品、杀虫剂和染料中,并随着人类的生活和生产活动被释放在水和土壤中,造成了严重的环境污染
吉林大学生命科学学院分子酶学工程工程教育部重点实验室高仁钧教授团队与丹麦奥胡斯大学郭诤教授团队合作构建了嗜热外二醇双加氧酶Tcu3516,研究显示该酶在酚类污染物降解方面具有巨大应用潜力。相关研究内容已于近日以题为A new thermophilic extradiol dioxygenase promises biodegradation of catecholic pollutantsjiesh在线发表于Journal of Hazardous Materials (2022,422:126860)
儿茶酚类物质作为重要的化学试剂广泛地被应用于制药工业、化工、化妆品、杀虫剂和染料中,并随着人类的生活和生产活动被释放在水和土壤中,造成了严重的环境污染。外二醇双加氧酶广泛存在于芽孢杆菌、假单胞菌和产碱菌等微生物中,可以催化儿茶酚类污染物中与羟基相邻的C-C键的断裂,是酚类污染物的生物降解途径中最重要的酶。已报道的双加氧酶多是常温酶,与常温酶相比,嗜热酶在温度耐受、抗化学物质变性、抗蛋白水解方面表现更优越,更具有工业应用潜力。因此,获得高性能、高稳定性的嗜热双加氧酶具有重要的研究价值。
高仁钧教授团队从嗜热微生物弯曲热单孢菌中筛选得到高活性的外二醇双加氧酶Tcu3516,并对其酶学性质进行了表征。通过对Tcu3516序列相似性分析,发现其属于邻氧螯合家族(VOC)/Ⅰ型,且该酶与已报道的其他双加氧酶的序列一致度仅为25-44 %。经过系统发育树分析进一步证明,该酶属于独特分支的、尚未被研究的双加氧酶。酶学性质表征表明,该酶最适温度为50 ℃,最适pH为9.0。且在55 ℃时,该酶仍具有良好的热稳定性。Tcu3516具有广泛的底物适应性,对多种天然底物,包括儿茶酚、3-甲基儿茶酚、3-氯儿茶酚、4-氯儿茶酚、2,3-二羟基邻苯二酚和3,4-二羟基苯基乙酸均有催化能力,特别适合用于环境污染物的清除。通过对Tcu3516进行同源建模,并与底物分子对接(图1),动力学模拟了解该酶与底物的作用方式。并再此基础上,通过半理性设计对其催化口袋末端的环结构进行改造,获得性能良好的突变体。
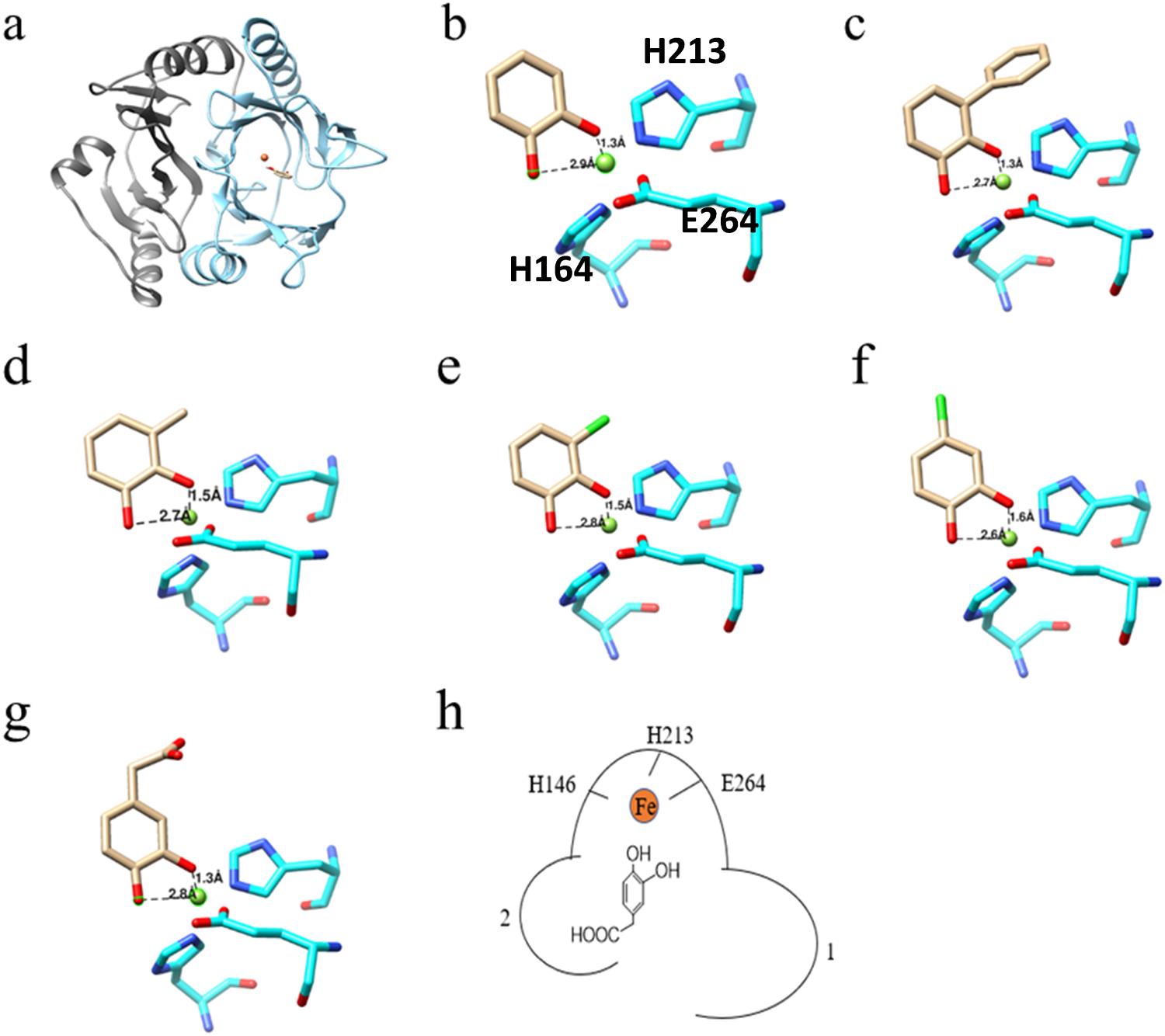
图1. Tcu3516结构的建模及底物与活性中心的对接。
为了进一步拓展Tcu3516的底物适应性,对Tcu3516催化口袋末端入口处loop环上的较大氨基酸残基进行定点突变,得到3个突变体F301V、D285A和H205V。经检测,不同突变体对于不同的儿茶酚类底物的催化活性均明显提高(图2),其中D285A的酶活力提高了2-17倍。结合酶促反应动力学结果进一步表明,催化口袋末端的环对酶底物特异性和催化效率有着重要的影响。对已获得的7个突变体的性质分析结果表明,位于盖子结构的F301V对于中链酰基儿茶酚和超长链酰基儿茶酚的催化能力均强于野生型。此结果证明了盖子结构的调整也会提高酶对大底物的催化作用,揭示了盖子结构的重要性(图3)。
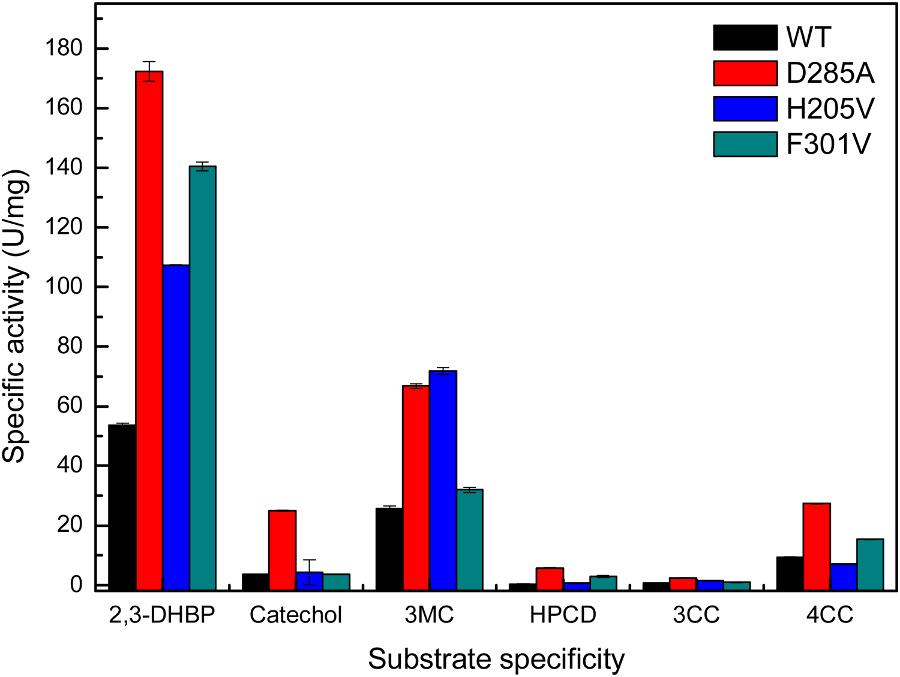
图2. 酶和突变体的底物特异性
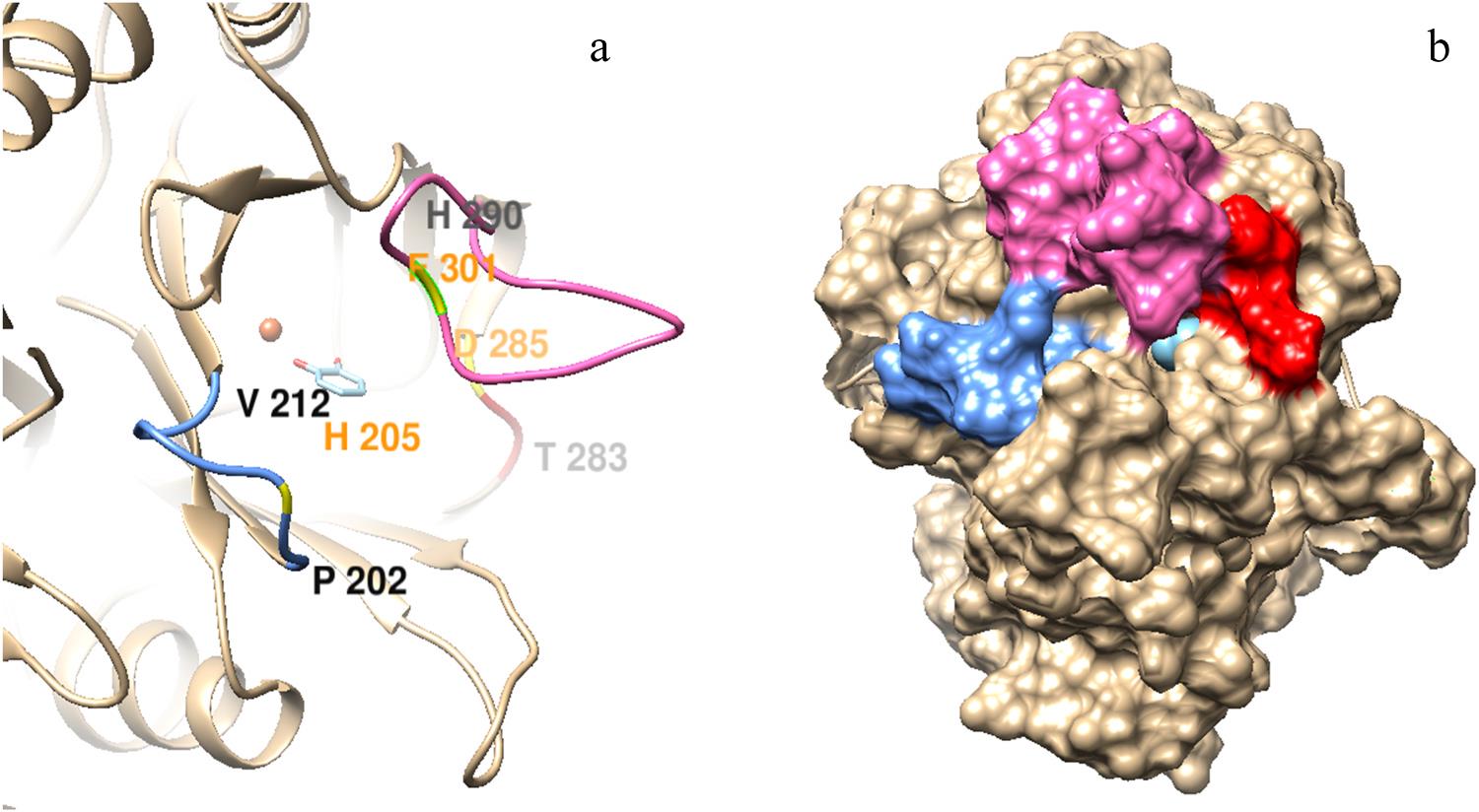
图3. (a) C端结构域及,(b)酶底物复合体
本研究通过筛选得到了新的嗜热外二醇双加氧酶Tcu3516,并构建了高稳定性高催化活性的突变体,在酚类污染物降解方面具有巨大应用潜力,适用于土壤有机污染物的清除和环境修复,如东北黑土地资源的保护。
本研究工作得到了国家自然科学基金、诺和诺德基金会和丹麦自由研究基金会的资助。论文第一完成单位为吉林大学,第一作者为吉林大学生命科学学院张晓雯博士。吉林大学生命科学学院分子酶学工程教育部重点实验室高仁钧教授与丹麦奥胡斯大学技术科学学院郭诤教授为论文的共同通讯作者。
论文全文链接:https://www.sciencedirect.com/science/article/pii/S0304389421018288