
-

生物通官微
陪你抓住生命科技
跳动的脉搏
王陈继组合作揭示CRL2-KLHDC3 E3连接酶复合体调控卵巢癌细胞铁死亡的分子机制
【字体: 大 中 小 】 时间:2021年12月02日 来源:复旦大学生命科学学院
编辑推荐:
王陈继组合作揭示CRL2-KLHDC3 E3连接酶复合体调控卵巢癌细胞铁死亡的分子机制
复旦大学生命科学学院王陈继副研究员和医学院病理系章平肇副研究员、哥伦比亚大学顾伟教授、上海市第一妇婴保健院高昆研究员合作,在2021年11月7日Cell Death & Differentiation杂志在线发表了题为“CRL2-KLHDC3 E3 ubiquitin ligase complex suppresses ferroptosis through promoting p14ARF degradation”的最新研究成果。
铁死亡 (ferroptosis)是近年来发现的一种新的细胞死亡方式,是在小分子物质诱导下发生的氧化性细胞死亡,具有铁离子依赖性。其发生是细胞内脂质活性氧(ROS)生成与降解的平衡失调所致,但其具体机理和调控方式还
完全清楚。铁死亡与代谢、神经退行性疾病和肿瘤等多种疾病密切相关,并且可以通过激活或抑制铁死亡来干预疾病的发展,因此铁死亡成为近年来的研究热点。SLC7A11是一个参与胱氨酸转运的离子通道蛋白。细胞通过SLC7A11运输胱氨酸到细胞内,而胱氨酸是细胞合成谷胱甘肽的主要原料。铁死亡诱导剂Erastin,通过直接抑制SLC7A11,阻碍胱氨酸吸收,降低了细胞内谷胱甘肽的含量,致细胞抗氧化能力下降,脂质活性氧上升,最终引起铁死亡。p14ARF是一个著名的肿瘤抑制基因,在多种肿瘤突变或缺失。2017年顾伟教授报道了p14ARF能诱导铁死亡,分子机制是p14ARF可以和转录因子NRF2结合,抑制了NRF2介导的SLC7A11转录活性。因此p14ARF通过促进铁死亡来抑制肿瘤。但是该作用模式是否受到调控还不清楚。
p14ARF是一个半衰期很短的蛋白,其蛋白稳定性主受Cullin家族的E3连接酶控制,但其分子细节还不清楚。研究人员通过siRNA筛选和蛋白复合体亲和纯化质谱等技术手段,鉴定到Cul2 E3连接酶的底物识别亚基KLHDC3是介导该过程的具体分子。KLHDC3在卵巢癌中显著上调表达。KLHDC3和Cul3、RBX1蛋白组装成一个E3泛素连接酶复合体,介导了 p14ARF的泛素化降解。KLHDC3高表达导致的p14ARF蛋白水平下降解除了 p14ARF对NRF2 的抑制作用,促进了 NRF2 介导的SLC7A11表达,抑制铁死亡,从而达到促进肿瘤的目的。研究人员还发现p14ARF C末端的一个RGPG基序是其结合KLHDC3所必需。有趣的是,该基序在小鼠同源蛋白p19arf中是不存在的,实验也证实小鼠的Klhdc3对p19arf源没有调控作用。这一现象可能和人、鼠在进化过程中不同的肿瘤抑制途径有关。
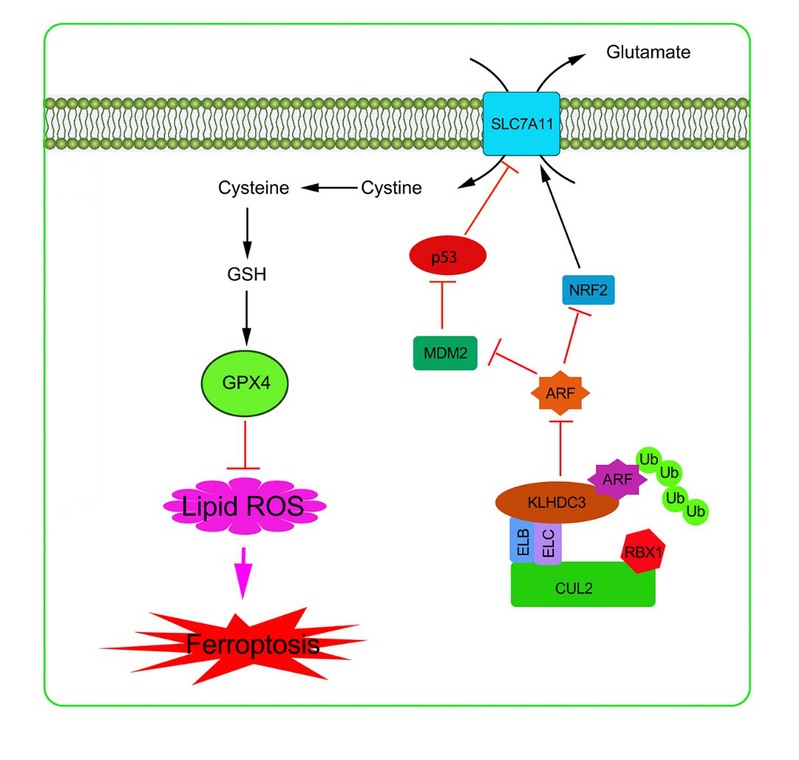
CRL2-KLHDC3 E3连接酶复合体调控卵巢癌细胞铁死亡的分子机制示意图
章平肇副研究员、生命科学学院博士生张亮和一妇婴高昆研究员为该论文的共同第一作者。王陈继副研究员、章平肇副研究员、顾伟教授和高昆研究员该论文的共同通讯作者。
原文链接: https://www.nature.com/articles/s41418-021-00890-0