
-

生物通官微
陪你抓住生命科技
跳动的脉搏
如何提高PCR产物克隆的效率[心得点评]
【字体: 大 中 小 】 时间:2002年08月13日 来源:生物通
编辑推荐:
生物通编者按:把PCR产物克隆到载体上常见有3种做法:
1.直接克隆到T载体(或者U载体上)
2.引物设计时引入酶切位点,PCR产物酶切后直接克隆到目标载体上
3.将平末端PCR产物直接克隆到平末端酶切载体上。
方法3主要是针对高保真的聚合酶比如Stratagene公司的Pfu酶,New England Biolabs公司的Vent酶,以及QIAGEN公司新出的同时具有热启动功能的高保真ProofStart酶,进行PCR扩增,由于这类酶有很强的校读功能,能够以模版为准切掉错配的碱基,因而得到的PCR产物多数是平末端,不能用T载体克隆。通常需用目的载体多克隆位点上的平末端单酶切位点,单酶切得到平末端的线性片断,直接连接PCR产物。这类酶得到的产物通常不能用TA克隆试剂盒。目前也有商业化的平末端PCR产物克隆试剂盒,不过较少用。平末端的连接效率低,通常需要高浓度的连接酶,较长的连接时间,合适的片断:载体比例,有的时候还需要调整反应体系的ATP浓度或者增加聚乙二醇(PEG2000),以得到较高的连接效率。许多厂家都有推出快速连接试剂盒,比如New England Biolabs新出的5分钟快速连接试剂盒,能够简化平端连接步骤和条件,缩短连接时间,提高连接效率。
不过需要注意的是一些厂家(例如Clontech、Gibco/BRL、Roche)也生产一些用于PCR的高保真混合酶,是采用常规Taq酶和一些有校读功能的(proofreading)的聚合酶按比例混合(这样得到的混合酶的保真性比普通Taq酶高一点,但通常不如Pfu、ProofStart等酶),因而得到的PCR产物也是平端和A末端的混合产物,是否能用TA克隆试剂盒需要参考厂家的说明。
方法2是比较常用的经济的方法,不需要购买T载体,可以直接通过酶切PCR产物,得到粘末端,直接连接到目的载体上。在顺的时候,这种方法是非常简单的。可有时候也会出问题,双酶切就是连不上,比较常见的原因是PCR产物双酶切不完全,比如没有纯化产物就直接双酶切,有的酶比较“娇气”容易出现“切不动”或者是“星号活力”,得不到正常的粘末端而连不上。有时是因为选定的两种酶反应条件相差比较大,为了省事同时双酶切(通用Buffer不是一定通用的,不能过分迷信,有时会成为莫名其妙出错的根源),也会出现类似的错误。还有一种情况是由于有些酶在酶切时需要一定的“占位空间”,也就是要求酶切识别序列的前后有一定数量的碱基才能正常酶切,而设计引物时酶切位点直接就在5’末端,没有留下足够的保护碱基而导致PCR产物酶切不动,无法正常的克隆。由于这些错误很难检查,有的时候会浪费大量的时间,还是莫名其妙没有结果。
由于常见的Taq酶或者没有校读功能的DNA聚合酶(即不是高保真)在PCR扩增的时候通常会在PCR产物末端多添加一个A(即增加一个模版上不存在的A)。这个突出的A成为PCR产物TA克隆技术的基础。带有互补的突出T末端的线性载体能够有效提高PCR产物的克隆效率,解决方法2遇到的难题,所以方法1也是目前比较常见的方法。
TA克隆在顺的时候也很简单,简直就是“a piece of cake”,不用考虑酶切位点,引物设计等等问题,好的载体克隆效率高、重组率高而且两端有丰富的单酶切位点便于后继的克隆,但是烦的时候也会出现无缘无故克隆不上或者重组率很低的问题。比较容易忽略的问题是用高保真的酶进行PCR扩增,应该选用平端克隆载体而错用了TA载体。常见但很难解决的问题则是由于T末端容易和其他碱基错配而导致自身环化或者克隆了引物/自身褪火引物二聚体或者PCR不完整产物,因而出现假阳性。因而QIAGEN公司推出了UA克隆试剂盒,用突出的U末端代替T末端,由于U碱基能够有效减低和其他碱基(T、C、G)非特异退火的几率,因而能有效提高PCR产物的克隆效率。
但是,是否还有其他因素会影响PCR产物的克隆效率呢?最近,QIAGEN公司的研发专家发现,PCR引物5’端的碱基(也就是引物第一个碱基)的不同,会影响PCR产物的克隆效率!以后设计引物可要注意了!看看QIAGEN的专家怎么说——
Ralf Peist, Dorothee Hosel, Thea Tutjes, and Dirk Loffert
基于UA的克隆技术广泛应用于PCR产物的快速、简便和高效的克隆。由Taq DNA聚合酶为PCR产物添加的多出来的一个A碱基能够和pDrive Cloning Vector(QIAGEN PCR CLoning Kit提供)载体上的互补的U碱基配对结合。PCR产物能够高效地结合到载体上,无需在引物中引入限制性内切酶位点,无需酶切或者平端连接。
在某些特殊情况下,由于一些未知的原因,一些表面很正常的PCR产物的克隆效率却很低。在这里,我们证实:PCR引物的5’末端碱基能够显著影响TaqDNA聚合酶添加A末端的效率——有的时候导致只有一小部分PCR产物带有A末端,从而使PCR产物克隆效率明显降低。在这里我们提供一些简单的建议如何提高这些“难克隆”的PCR产物的克隆效率。
材料和方法
GeneScan®分析以确定PCR产物的长短
用QIAGEN公司的QIAprep Spin Miniprep提取质粒pTZ19R。采用没有校正功能的DNA聚合酶和特异性引物分别扩增质粒上的112bp、213bp和363bp片断。每个片断的扩增都分别进行4组反应,采用同一个荧光标记的正向引物(forward primer)和4个不同的反向引物之一进行扩增,4个reverse primer的区别仅在于引物的5’端碱基分别为(A、T、G、C),其他序列都相同。PCR产物用ABI PRISM 377测序仪分析,并用ABI GeneScan分析软件进行分析。
分析克隆效率
用DNeasy Tissue Kit和QIAamp DNA Blood Mini Kit分别纯化小鼠和人类基因组DNA。用QIAGEN Taq DNA聚合酶或者HotStarTaq DNA聚合酶分别扩增小鼠p53基因上一段500bp的片断、人类prion蛋白基因上一段750bp的片断,以及人类白介素9基因上一段1000bp的片断。每个片断的扩增都分别进行4个反应,分别采用4对引物(区别仅在于5’末端碱基分别为A、T、G、C,其他序列相同,如表1)进行扩增。PCR产物克隆到QIAGEN PCR克隆试剂盒中的pDrive Cloning Vector中。计算克隆数,以其中一组5’端带A碱基的克隆数为基准(normalized to)进行比较,结果如图。
Table1:Conbinations of primers used to genetate a 1000 bp fragment of the human interleukin 9 gene | ||
| PCR fragment | Forward primer | Reverse Primer |
| A | 5’-ACTC...TGC-3’ | 5’-ACGC...TGT-3’ |
| C | 5’-CCTC...TGC-3’ | 5’-CCGC...TGT-3’ |
| G | 5’-GCTC...TGC-3’ | 5’-GCGC...TGT-3’ |
| T | 5’-TCTC...TGC-3’ | 5’-TCGC...TGT-3’ |
结果和讨论
引物的5’末端碱基对添加A末端反应的影响
没有校读功能的DNA聚合酶如Taq酶,会在PCR产物的3’末端添加多一个A(即:比模版多加一个A)为了比较引物的5’末端碱基对添加A末端反应的影响,我们比较了3个不同片断的各4组PCR产物的长短。结果表明:引物5’末端是A碱基的,PCR产物末端添加A的效率最高。引物5’末端是G的,PCR产物末端添加A的效率也很高,但是反应时间的延长,会导致添加2个A,从而影响后继的PCR产物克隆。
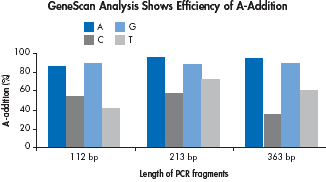 |
| The effect of the primer’s 5’terminus on A-addition was investigated using 3 different PCR products. Efficiency of A-addition was deternined by analyzing the PCR product length on an ABI PRISM 377 Sequencer. Absolute percentages of A addition for each fragment are shown. |
引物5’末端碱基对PCR产物克隆效率的影响,以及连接时间对克隆的影响
既然引物的5’末端碱基的不同会影响PCR产物末端添加A的反应效率,我们也研究了这种现象对PCR产物克隆的影响。结果表明PCR产物克隆效率与添加单个A碱基的效率正相关,引物5’末端是A的PCR产物得到的重组阳性克隆(insert-bearing colonies)最高。不同长短的片断克隆结果都证实了这一点。因此,引物设计时应该尽可能在5’末端添加A碱基。
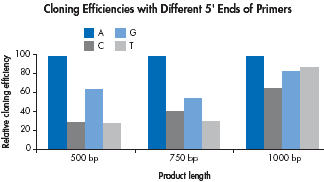 |
| The effect on the cloning efficiency for primers with different 5’ ends was investigated using 3 different PCR products. Each of the 4 reverse primers was identical except for a different base(A,C,G,T, as indicated) at the 5’ terminus. The PCR products were cloned into the pDrive Cloning Vector using the QIAGEN PCR Cloning Kit. Numbers of colonies were normalized to the number obtained when both primers contained a 5’-terminal A. |
如果引物设计时5’末端无法加A,延长连接时间能够弥补克隆效率的不足。30分钟的连接时间能够保证引物末端带A的PCR产物有足够高的克隆效率。如果延长连接时间到2小时,能够显著提高引物末端带C的PCR产物克隆效率。
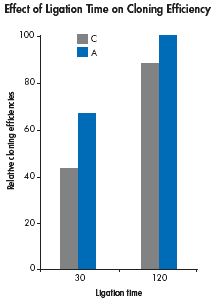 |
| The effect of ligation time on cloning efficiency was determined for two 1000bp PCR fragments,generated using primers containing either 5’-terminal Cs or 5’-terminal As. The PCR products were cloned using the QIAGEN PCR Cloning Kit with the indicated ligation times. Numbers of colonies were normalized to the number obtained using primers containing a 5’- terminal A and a 120-minute ligation time. |
结论
1.QIAGEN PCR Cloning Kit能够简单快速将PCR产物克隆到PCR载体中,采用QIAGEN试剂盒中特制的感受态细胞,只需要40分钟可以完成从克隆到涂板的全过程。
2.偶然,PCR产物克隆效率会意外的低,此时可以通过设计一对5’端带A的引物(引物的第一个碱基是A),这样可以提高Taq酶在PCR产物末端添加A的效率,从而提高PCR产物在UA(TA)载体的克隆效率。
3.如果不能在引物5’端加A,可以通过延长连接时间来提高克隆效率。