
-

生物通官微
陪你抓住生命科技
跳动的脉搏
组氨酸甲基化辅助U2AF1执行剪接功能的关键作用
【字体: 大 中 小 】 时间:2024年09月12日 来源:中国科学院生物化学与细胞生物学研究所
编辑推荐:
国际知名学术期刊 Nature Communications在线发表了中国科学院大连化学物理研究所叶明亮研究组、中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)程红研究组、中国科学院大连化学物理研究所李国辉研究组以及中国科学院上海营养与健康研究所王泽峰研究组的合作研究成果:“ Metabolic labeling based methylome profiling enables functional dissection of histidine methylation in C3H1 zinc fingers”
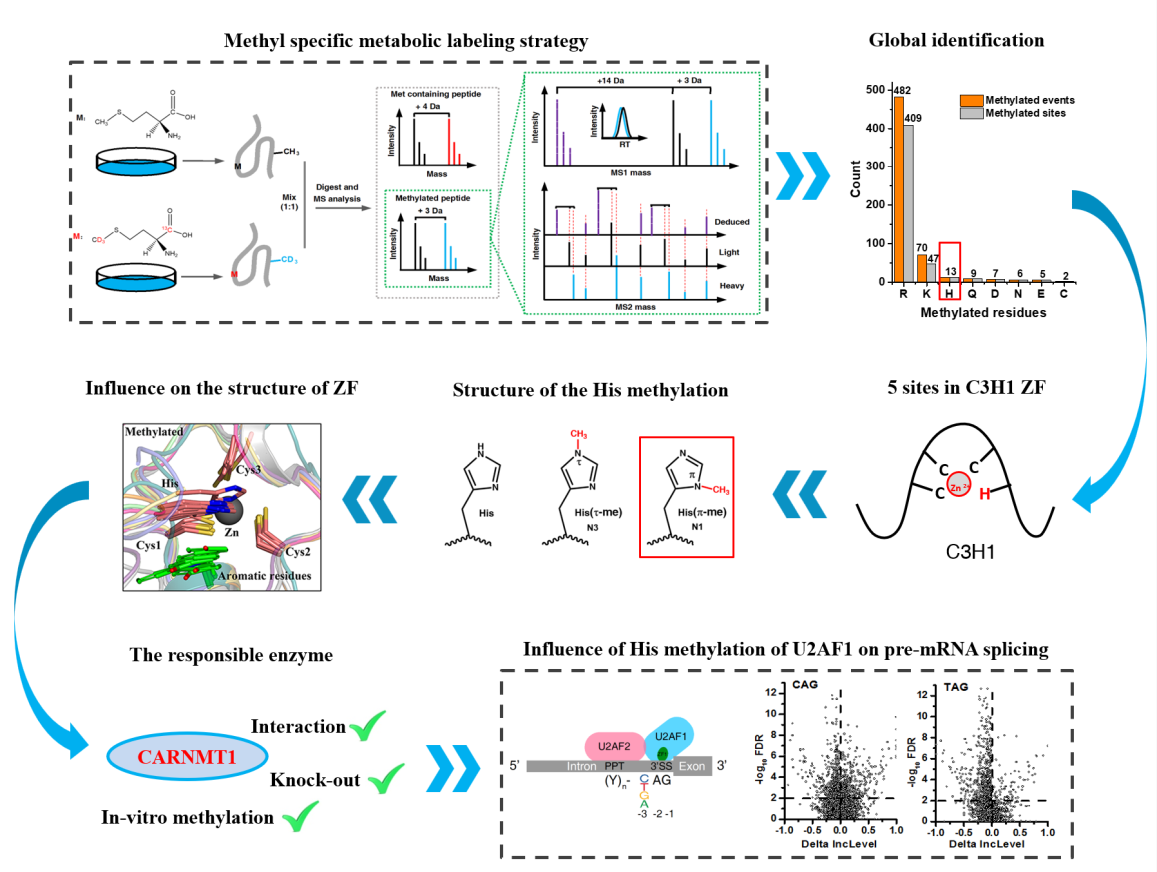
8月28日,国际知名学术期刊Nature Communications在线发表了中国科学院大连化学物理研究所叶明亮研究组、中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)程红研究组、中国科学院大连化学物理研究所李国辉研究组以及中国科学院上海营养与健康研究所王泽峰研究组的合作研究成果:“Metabolic labeling based methylome profiling enables functional dissection of histidine methylation in C3H1 zinc fingers”。该研究利用一种新的全景式蛋白质甲基化分析技术,揭示了组氨酸甲基化对维持C3H1锌指结构的必要性,并发现组氨酸甲基化对U2AF1 3’剪接位点的识别与外显子剪接的重要辅助作用,拓宽了对蛋白质甲基化在生物学过程中的调控功能的认知。
蛋白质甲基化作为一种关键的翻译后修饰,在多种生理过程中扮演着重要角色。尽管精氨酸和赖氨酸甲基化已被广泛研究,但其他氨基酸侧链的甲基化修饰由于缺乏有效的分析方法,至今仍未得到充分解析。
在叶明亮研究员、程红研究员、李国辉研究员以及王泽峰研究员的指导下,研究人员利用新开发的同位素标记偶联质谱技术,鉴定到了多个C3H1锌指蛋白上的组氨酸甲基化修饰及其对应的甲基转移酶CARNMT1。
为了研究组氨酸甲基化修饰的生物学功能,研究人员以CARNMT1底物蛋白U2AF1为切入口,通过对CARNMT1 KO细胞与U2AF1 KD细胞的RNA-seq,发现甲基化的缺失会导致大量U2AF1相关的可变剪接事件的发生。进一步地,对U2AF1的eCLIP结果显示,甲基化的缺失会显著降低U2AF1对3’剪接位点的识别能力。分子模拟结果显示,组氨酸甲基化修饰有助于维持锌指结构的稳定性,提示该修饰是调控锌指蛋白活性的一种普遍机制。
大连化学物理研究所王科云博士,分子细胞卓越中心张力博士、上海营养与健康研究所张思蕊博士、大连化学物理研究所刘野博士、毛家维博士、刘震博士为该文的共同第一作者。大连化学物理研究所叶明亮研究员、分子细胞卓越中心程红研究员、大连化学物理研究所李国辉研究员以及上海营养与健康研究所王泽峰研究员为该论文的共同通讯作者。感谢分子细胞卓越中心细胞分析技术平台与分子生物学技术平台的大力支持。该项研究工作得到国家重点研发计划项目、国家自然科学基金、中国科学院战略性先导科技专项以及中国科学院大连化学物理研究所创新基金等项目的支持。
文章链接:https://doi.org/10.1038/s41467-024-51979-2
组氨酸甲基化帮助维持C3H1锌指结构,并且辅助U2AF1执行剪接功能