
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Reports Physical Science | 中国科大王毅课题组开发新型LY...
【字体: 大 中 小 】 时间:2024年12月14日 来源:中国科学技术大学生命科学与医学部基础医学院
编辑推荐:
2024 年 12 月 11 日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗重点实验室王毅课题组在 Cell Reports Physical Science 在线发表了一篇题为“ A heparanase-specific LYTAC degrader reinforces natural killer cell cytotoxicity within tumor microenvironment ” 的研究文章

近年来,为了突破现有药物研发技术的诸多瓶颈,靶向蛋白降解(Targeted Protein Degradation, TPD)技术应运而生。这一技术为药物开发开辟了新的路径,其核心原理在于利用细胞自身的蛋白质降解机制(例如蛋白酶体途径、溶酶体途径等)来实现靶蛋白的降解。其中,溶酶体靶向嵌合体(lysosome-targeting chimeras, LYTACs)技术,由2022年诺贝尔化学奖得主Carolyn Bertozzi首次提出,作为一种新型的TPD策略,显著拓展了TPD的应用范围,不仅限于胞内蛋白,还包括胞外蛋白和膜蛋白。目前,LYTAC技术已在肿瘤治疗、慢性眼病以及神经退行性疾病等多个领域展现出应用潜力。LYTAC技术依赖于溶酶体受体来实现靶蛋白的降解,其中,ASGPR(Asialoglycoprotein Receptor)是一种特异性表达于肝细胞的溶酶体靶向受体,其主要生理功能是帮助肝细胞清除循环系统中缺乏N端寡糖链的老化蛋白质。因此,通过设计ASGPR配体构建的LYTAC化合物,能够高效地通过肝细胞溶酶体途径降解分泌至胞外及膜上的靶蛋白,表现出高安全性和低毒副作用,巧妙地利用了机体清除老化蛋白的自然机制来降解与疾病相关的靶蛋白,具有重要的临床转化价值。

2024年12月11日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗重点实验室王毅课题组在Cell Reports Physical Science在线发表了一篇题为“A heparanase-specific LYTAC degrader reinforces natural killer cell cytotoxicity within tumor microenvironment”的研究文章。本研究采用LYTAC技术设计合成了一种针对肝癌微环境中肝素酶(heparanase, HPA1)的靶向降解化合物JW-9。该化合物通过增加肿瘤细胞表面硫酸乙酰肝素蛋白聚糖(HSPGs)的丰度,激活自然杀伤(NK)细胞表面的自然细胞毒性受体(NCRs),从而显著增强了NK细胞对肝癌的识别与杀伤能力。此外,该LYTC化合物JW-9巧妙利用机体清除老化蛋白的ASGPR系统来降解肝瘤靶蛋白HPA1,因地制宜地借助肝癌细胞自身溶酶体系统降解肝癌免疫抑制性分子,从而增强NK细胞的抗肝癌效应。
在本研究课题中,设计了一种名为JW-9的LYTAC双功能化合物,该化合物包含两个不同的结合区域,这两个区域通过一个化学连接子(linker)连接。其中一个结合区域能够与肝细胞表面的特异性跨膜受体ASGPR相结合,此受体负责将携带N-乙酰半乳糖胺(N-acetylgalactosamine, GalNAc)标记的蛋白质转运至溶酶体进行降解。另一个结合区域则与目标蛋白(protein of interest, POI)结合,用于识别特定的胞外蛋白,即JW-9的目标蛋白HPA1。当JW-9分子的两个结合区域同时与其各自的配体结合时,会形成一个三元复合物(ASGPR-LYTAC-HPA1)。随后,该复合物会被细胞膜内吞,形成运输囊泡,将复合物运送至溶酶体进行降解,而ASGPR受体则被回收利用,重新回到细胞膜上准备下一次的降解过程。随着HPA1的降解,肝瘤细胞表面的HSPGs丰度增加,从而促进NK细胞对肝癌的识别与杀伤能力,使得NK细胞突破肿瘤微环境的抑制性屏障(见图1)。
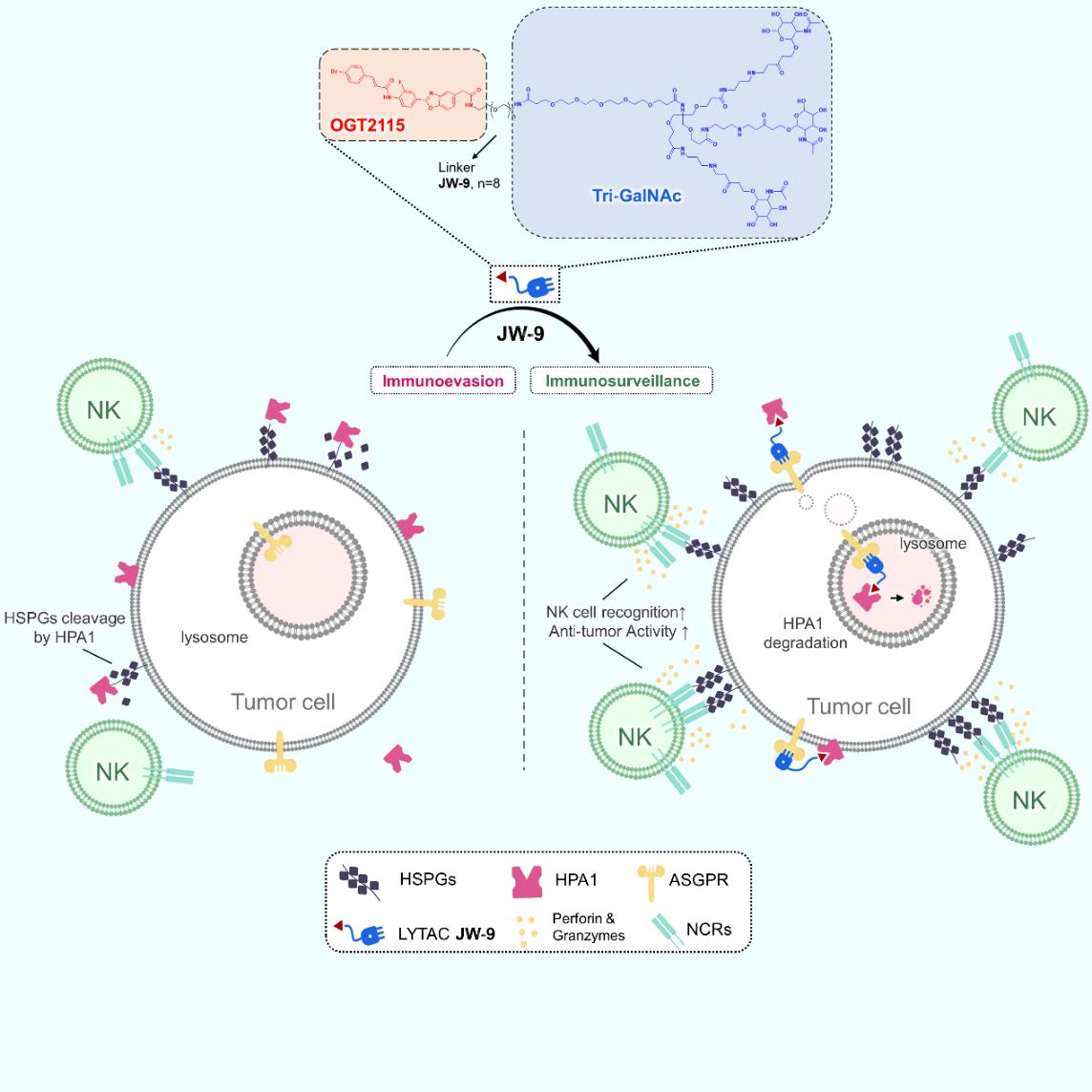
图1 LYTAC化合物JW-9增强 NK 细胞的抗肝癌效应
综上所述,JW-9借助ASGPR-GalNac系统靶向降解肝癌中介导免疫抑制的靶蛋白HPA1,该体系安全可靠且毒副作用低,不但克服了传统靶向药 “仅占位
降解”的难题,而且通过肿瘤免疫学与化学生物学的交叉融合,为肝癌免疫治疗提供了安全有效的新思路,为后续深入探究靶向降解蛋白技术在肿瘤中的应用提供了新线索。
中国科学技术大学生命科学与医学部博士生李昀佳、博士后沈亦青、附属第一医院陈浩副主任医师为该论文的第一作者。中国科学技术大学基础医学院、免疫应答与免疫治疗重点实验室王毅研究员和金晶副研究员为该论文的通讯作者。该研究工作获得了中国科学技术大学生命科学与医学部魏海明教授、薛林教授,附属第一医院黄玫副研究员等合作团队的大力支持,以及中国科学院战略性先导科技专项、国家自然科学基金、安徽省自然科学基金、合肥综合性国家科学中心大健康研究院全球遴选项目-创新药物等项目资助。
文章链接:https://www.cell.com/cell-reports-physical-science/fulltext/S2666-3864(24)00653-2
10x Genomics闁哄倹婢橀幖顪渋sium HD 鐎殿喒鍋撻柛姘煎灠瀹曠喓绱掗崱姘姃闁告帒妫滄ご鎼佹偝閸モ晜鐣遍柛蹇嬪姀濞村棜銇愰弴鐘电煁缂佸本妞藉Λ鍧楀礆閸℃ḿ鈧粙鏁嶉敓锟�
婵炲棎鍨肩换瀣▔鐎n厽绁癟wist闁靛棗锕g粭澶愬棘椤撶偛缍侀柛鏍ㄧ墱濞堟厤RISPR缂佹稒鐩埀顒€顦伴悧鍝ヤ沪閳ь剟濡寸€n剚鏆╅悗娑欏姃閸旓拷
濞戞挸顑堝ù鍥Υ婵犲嫮鐭庨柤宕囧仜閸炴挳鎽傜€n剚顏ら悹鎰╁妺缁ㄧ増鎷呭⿰鍐ㄧ€婚柡瀣姈閺岀喎鈻旈弴鐘虫毄閻庢稒鍔掗崝鐔煎Υ閿燂拷
 鐎殿喗娲熼。顐ゆ偘鐏炶偐鐟归懕绲撮懕浠嬫嚂濮樺崬濡藉Δ鐧稿婢规帞绱掑Ο鎸庣殤濞寸媴缍€闂冭法绱掗崟顐妳闁轰胶绻濈紞瀣喆閿濆懎鏋€闁哄倽顫夐、锟�>>
鐎殿喗娲熼。顐ゆ偘鐏炶偐鐟归懕绲撮懕浠嬫嚂濮樺崬濡藉Δ鐧稿婢规帞绱掑Ο鎸庣殤濞寸媴缍€闂冭法绱掗崟顐妳闁轰胶绻濈紞瀣喆閿濆懎鏋€闁哄倽顫夐、锟�>>  闁靛棗鑻妵鍥╀焊韫囨稓鐐婄紒璁虫祰閸嬫稒绋夋惔鈥叉樊閹兼挳顥撻鎼佹偠閸℃劏鍋撳鍡楃樄閻庨潧鍚嬮幑锝夊箮閵夘垳绀夐柣鎰嚀閸ゎ噣宕¢崘鎻掕闁稿繐绉烽崹鍌涳紣閸℃绲块柣銏ゆ涧閻℃瑩鎮ч崼鐔风仐閻庡湱鍋樼紞瀣归柨瀣�>>
闁靛棗鑻妵鍥╀焊韫囨稓鐐婄紒璁虫祰閸嬫稒绋夋惔鈥叉樊閹兼挳顥撻鎼佹偠閸℃劏鍋撳鍡楃樄閻庨潧鍚嬮幑锝夊箮閵夘垳绀夐柣鎰嚀閸ゎ噣宕¢崘鎻掕闁稿繐绉烽崹鍌涳紣閸℃绲块柣銏ゆ涧閻℃瑩鎮ч崼鐔风仐閻庡湱鍋樼紞瀣归柨瀣�>>  闁规椿鍘鹃~婵嬪础閺囩姷鐭庨柤宕囧仦缁佸瓨鎯旈敓锟�-婵烇絽宕崣鍡樼閸℃鎺撴交濞嗘挶鈧秴顫㈤敐鍛含闁衡偓閻熸澘缍侀柟瀛樺灣濠婃垵顕i埀顒備沪閺囩媭娼犻悗娑冲閻栬櫣绮氶崜浣圭暠闁瑰灈鍋撻柡鍫嫹>>
闁规椿鍘鹃~婵嬪础閺囩姷鐭庨柤宕囧仦缁佸瓨鎯旈敓锟�-婵烇絽宕崣鍡樼閸℃鎺撴交濞嗘挶鈧秴顫㈤敐鍛含闁衡偓閻熸澘缍侀柟瀛樺灣濠婃垵顕i埀顒備沪閺囩媭娼犻悗娑冲閻栬櫣绮氶崜浣圭暠闁瑰灈鍋撻柡鍫嫹>>  濞戞挻鐗滈弲顐︽媼濡も偓閹槕hermo Fisher閻犙勭洴缁垱顦伴悙鎵懐閻忓繑姊婚~鏍箮閳ь剟骞忓☉婊€绮ield Application Scientist闁靛棔搴渁rketing Develop缂佹稑顦虫禍瀛樻媴瀹ュ繒绀夐悹鍥烽檮閸庡繒鎷犻柨瀣弨闁活亜顑囬弫鎾绘偋閳哄應鍋撳顐g溄闁归潧绉寸粩鍫曞捶閻戞ḿ鍩夐柣鈺婂櫙缁憋拷>>
濞戞挻鐗滈弲顐︽媼濡も偓閹槕hermo Fisher閻犙勭洴缁垱顦伴悙鎵懐閻忓繑姊婚~鏍箮閳ь剟骞忓☉婊€绮ield Application Scientist闁靛棔搴渁rketing Develop缂佹稑顦虫禍瀛樻媴瀹ュ繒绀夐悹鍥烽檮閸庡繒鎷犻柨瀣弨闁活亜顑囬弫鎾绘偋閳哄應鍋撳顐g溄闁归潧绉寸粩鍫曞捶閻戞ḿ鍩夐柣鈺婂櫙缁憋拷>>  闁告凹鍓濋鈺傛交閸パ勫亱闁挎稓鍠曠粔瀛樻交閿燂拷14濠㈠灈鏅涢悿鍕殽瀹€鈧悰銉╁矗閿濆洦鐣遍柤鍙夌箚閸撴壆绱掗崱姘姃闁挎冻鎷�>>
闁告凹鍓濋鈺傛交閸パ勫亱闁挎稓鍠曠粔瀛樻交閿燂拷14濠㈠灈鏅涢悿鍕殽瀹€鈧悰銉╁矗閿濆洦鐣遍柤鍙夌箚閸撴壆绱掗崱姘姃闁挎冻鎷�>>  生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
