
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PNAS | 服部素之团队合作首次解析锌离子激活通道ZAC的结构
【字体: 大 中 小 】 时间:2024年10月26日 来源:复旦大学生命科学学院
编辑推荐:
2024 年 10 月 24 日,复旦大学服部素之团队在 PNAS 发表文章“ Cryo-EM structure of the zinc-activated channel (ZAC) in the Cys-loop receptor superfamily ”
2024年10月24日,复旦大学服部素之团队在PNAS发表文章“Cryo-EM structure of the zinc-activated channel (ZAC) in the Cys-loop receptor superfamily”。该项目由复旦大学生命科学学院服部素之课题组与中国药科大学理学院汪津课题组合作完成。

该团队利用冷冻电镜单颗粒分析技术首次解析了Cys-loop受体超家族中的一类锌离子激活通道ZAC,并通过电生理技术对通道进行了突变分析。团队在胞外结构域中鉴定出锌离子活性相关位点,并发现该蛋白的通道构造有别于超家族其他成员,且找到离子选择性相关的重要位点,为理解ZAC的离子传导机制奠定了结构基础。
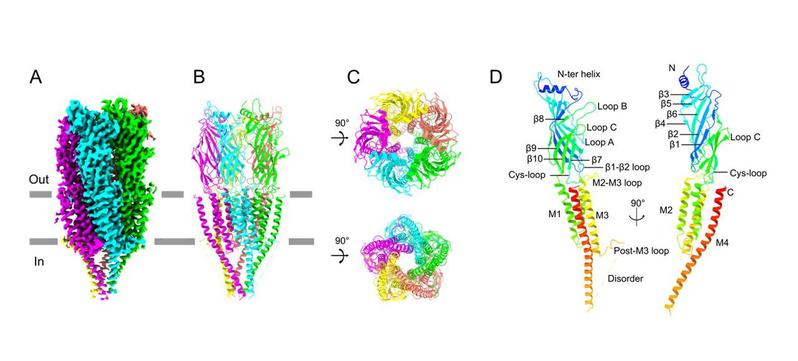
Cys-loop受体超家族是一类五聚体的配体门控离子通道,在人体神经系统中扮演关键角色,与多种神经退行性疾病相关。锌离子激活通道ZAC是最近才发现的一类Cys-loop受体蛋白,而它的结构信息在过去一直缺失。服部素之团队解析了来自青鳉的ZAC蛋白结构,该结构呈现子弹性状的五聚体构造,构成通道的每个单体都由四个跨膜螺旋和一个含N端螺旋和10个β-折叠的胞外结构域组成,表现出Cys-loop家族的常见构造。
从ZAC结构的表面静电分布来看,构成Cys-loop受体传统神经递质结合位点的loop C区域,以及靠近膜表面的Cys-loop区域,都呈现负电荷状态,而这些负电荷位置在突变分析中都能影响ZAC的锌离子活性,说明ZAC可能同时存在多个配体结合位点。
ZAC的离子通道最窄处在跨膜区域的Met261,这和其他Cys-loop蛋白的通道最窄处位置有所不同。在ZAC结构中测量Met261附近孔道半径不足2.76?,小于钠离子的水合半径。对组成跨膜通道的氨基酸做突变分析,推测出位于胞质侧通道开口处的Gly247参与到通道的离子选择性。
复旦大学生命科学学院服部素之研究员和中国药科大学理学院汪津副研究员是文章的共同通讯,研究生金斐(已就职酶有科技)与林义雨为该文章共同第一作者,复旦大学为第一通讯单位。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2405659121