|
||||||
|
|
||||||
 |
||||||

|
||||||
|
qPCR技术介绍(五)——绝对定量与相对定量 |
||||||
|
||||||
|
一、绝对定量 vs 相对定量 |
||||||
 |
||||||
| 定量方法可以区分为绝对定量和相对定量两大种类。
绝对定量是对未知样品的绝对量(拷贝数)进行测定的方法。 而相对定量,并不是测定基因的绝对量,而是分别测定目的基因和参比基因的量,再求出对于参比基因的目的基因的相对量,最后再进行样品间相对量的比较。 我们不能简单地说绝对定量准确还是相对定量准确,而只能说它们的应用领域不同。绝对定量应用于病毒病原菌定量检测、转基因拷贝数分析、GMO定量分析等领域;相对定量主要应用于mRNA表达量解析,如果此时采用绝对定量的方法,就不能得到准确的解析结果。 |
||||||
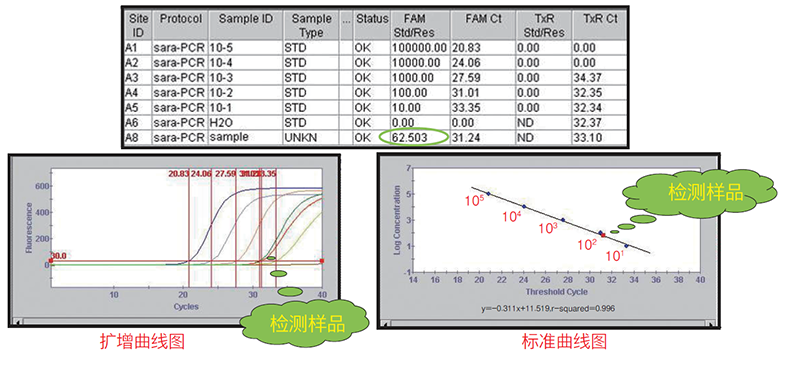
| 二、绝对定量 | ||||||
|
||||||
|
|
||||||
| 二、相对定量 | ||||||
| 相对定量,一般是为了比较感兴趣的目的基因,在不同的样本中表达量的差异。
那么如果通过前面介绍的绝对定量的方法,制作目的基因的标准曲线,再把几个待测样本中目的基因的Ct值带入曲线,获得目的基因的绝对量,再进行倍数关系比较,是否可以呢? |
||||||
| 【引入参比基因的必要性】 | ||||||
| 不同的样品,即使反应时使用相同量的Total RNA,但因细胞来源不同,RNA的总表达量并非一致。因此仅仅将反应时RNA量统一,起始的细胞数也不一定相同。而进行表达量比较时,不是RNA量相同,而是相同细胞数的RNA才是最重要的。 | ||||||
| 实际上要将样品材料(组织、细胞、菌体等)统一到相同细胞数提取,是非常困难的。 同时还不能保证RNA提取效率完全相同、PCR扩增效率完全相同等。 | ||||||
| 基于以上原因,利用Real Time RT-PCR方法进行基因表达解析,有必要选择House Keeping Gene(管家基因)作为参比基因来对所有样品进行归一化处理(RNA量校正),然后再对不同样品之间的目的基因表达量进行比较。 | ||||||
| 分别测定不同样本中目的基因和参比基因的量,再求出对于参比基因的目的基因的校正值,最后再进行样品间校正值的比较。 | ||||||
|
||||||
| 【管家基因的选择】 | ||||||
| 管家基因,是指所有细胞中稳定表达的一类基因,在qPCR中这类基因经常被选为参比基因,用来对所有样品进行归一化处理。 以前,GAPDH、β-actin基因常被作为管家基因使用,但近几年也常有这些基因因样品经药物等处理后表达量发生变化的报道。 目前,很多研究者认为一种管家基因有可能校正不充分,同时使用两个或两个以上的复数管家基因进行校正更值得信赖。 当然这种校正方法也是非常耗费精力的,通常要选择若干个管家基因同时进行表达量分析,从中选择表达量变化幅度小的管家基因来使用。 选择最适校正基因的软件有很多,请下载利用(geNorm、BestKeeper等)。 |
||||||
| 【△△Ct法与双标准曲线法】 | ||||||
| 相对定量解析大多采用标准曲线的定量方法,但也有不采取制作标准曲线的定量方法,如△△Ct方法等。 | ||||||
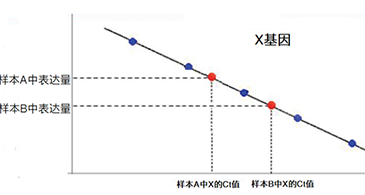
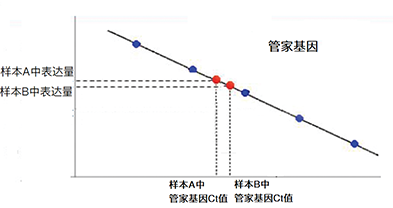
| 1、标准曲线法 | ||||||
|
||||||
|
||||||
|
||||||
| 2. delta-delta Ct(△△Ct)法 | ||||||
|
||||||
|
||||||
| 在扩增效率接近100%时,△△Ct法和标准曲线法得到的结果趋势是一致的。 | ||||||
| 更多详情请点击: |

|